
【题目】下列关于物质的分类或变化说法正确的是
A. Na2CO3、BaCl2是常见的强电解质,且溶于水时均会破坏水的电离平衡
B. NO2经降温加压凝成无色液体为物理变化,NO2排水收集到无色气体为化学变化
C. Na2OSiO2是一种简单的硅酸盐,露置于空气中会变质
D. 植物油可萃取溴水中的溴而使溴水褪色
科目:高中化学 来源: 题型:
【题目】依据有关信息解答下列化学实验问题:
(Ⅰ)醛类是重要的工业原料,可以跟亚硫酸氢钠饱和溶液反应,生成物是α﹣羟基磺酸钠(易溶于水,不溶于饱和亚硫酸氢钠溶液)R-CHO+NaHSO3![]() R-CH(OH)-SO3Na
R-CH(OH)-SO3Na
(1)上述反应类型为________反应。若使CH3 CH(OH)-SO3Na全部变成乙醛,可采用的试剂是__________或__________;分离乙醛的操作方法 _____________。
(Ⅱ)实验室利用苯甲醛(安息香醛)制备苯甲醇和苯甲酸的化学原理:
![]() (此原理适用于无α-氢的醛)
(此原理适用于无α-氢的醛)
已知部分物质的性质:
苯甲醇:熔点(℃):-15.3℃,稍溶于水,易溶于有机溶剂;
苯甲醛:熔点(℃):-26℃,微溶于水,易溶于有机溶剂;
苯甲酸:溶解度为0.344g(25℃),易溶于有机溶剂.主要过程如图所示:
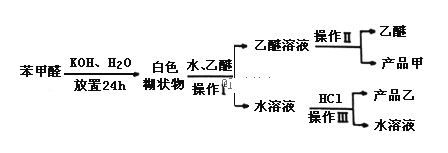
回答下列问题:
(2)操作Ⅰ的名称是___________,乙醚溶液中所溶解的主要成分是__________;
(3)操作Ⅲ的名称是________,产品乙是_______________.
(4)按上述操作所得的产品甲中常含有一定量的有机杂质___________(填写杂质的名称);限用下列试剂:酸性KMnO4、稀NaOH溶液、稀H2SO4、饱和NaHSO3溶液.写出检验产品甲中含有该杂质的过程:______________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为周期表中短周期的一部分。已知a原子的最外层上的电子数目是次外层电子数目的一半,下列说法中不正确的是( )

A. 元素a的最高价氧化物的水化物的酸性比b弱
B. 元素a的原子半径比d的大
C. 元素a的单质在空气中燃烧会导致“温室效应”
D. 元素a单质是一种良好的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(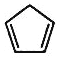 )是一种重要的化工原料。
)是一种重要的化工原料。
(1)工业上可用环戊二烯制备金刚烷
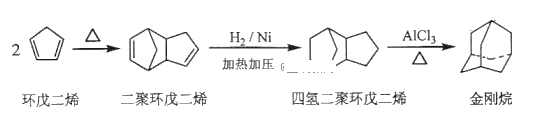
①环戊二烯分子中最多有_____________个原子共平面;
②金刚烷的分子式为___________,其二氯代物有________种。
③已知烯烃能发生如下反应:
![]()
请写出下列反应产物的结构简式:__________
![]()
(2)Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是 由环戊二烯和A经Diels-Alder反应制得
由环戊二烯和A经Diels-Alder反应制得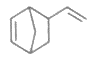 。
。
①Diels-Alder反应属于_______反应(填反应类型):A的结构简式为________________。
②写出与 互为同分异构,且一溴代物只有两种的芳香烃的名称_______,
互为同分异构,且一溴代物只有两种的芳香烃的名称_______,
写出生成这两种一溴代物所需要的反应试剂和反应条件_______________、______________。
③写出实验室由![]() 的属于芳香烃的同分异构体的同系物制备
的属于芳香烃的同分异构体的同系物制备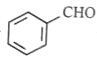 的合成路线流程图,合成路线流程图示例如下:
的合成路线流程图,合成路线流程图示例如下:
![]()
_______________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠与水反应的离子方程式正确的是( )
A. 2Na+3H+=2Na++H2↑
B. Na+H2O=Na++OH-+H2↑
C. 2Na+2H2O=2Na++2OH-+H2↑
D. 2Na+2H2O=2Na++O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要流程如下:

(1)为提高含锰矿物浸出速率,可采取的措施有______________(至少写出两条)。
(2)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。设备1中发生氧化还原反应的离子方程式是______________________________________。
(3)设备2中加足量双氧水的作用是________________________。设计实验方案检验滤液2中是否存在Fe2+________________________。
(4)已知金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表,加氨水调节溶液的pH等于6,滤渣2的主要成分为_____________ (填化学式)。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(5)设备4中加入过量氢氧化钠溶液,用离子方程式表示发生的反应______________。
(6)保持其他条件不变,在不同温度下对含锰矿物进行酸浸,锰浸出率随时间变化如图。酸浸的最佳温度与时间分别为________℃、______min。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的原料都是来源于石油化工,回答下列问题。
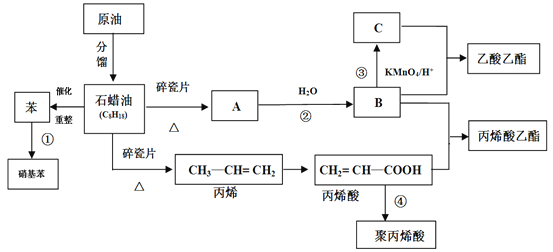
(1)A的结构简式为________。
(2)丙烯酸中含氧官能团的名称为_______。
(3)①③反应的反应类型分别_______、_______。
(4)写出下列反应方程式
①反应②的方程式_____________________;
②反应④的方程式_____________________;
③丙烯酸+B→丙烯酸乙酯________________。
(5)丙烯酸(CH2=CH—COOH)的性质可能有_______
①加成反应 ②取代反应 ③加聚反应 ④中和反应 ⑤氧化反应
A.只有①③ B.只有①③④
C.只有①③④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 2.0 mol·L-1 B. 1.5 mol·L-1 C. 0.18 mol·L-1 D. 0.24 mol·L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com