
| A. | 碘化亚铁溶液中通入少量氯气 2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 少量SO2通入次氯酸钙溶液中 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 用氨水吸收过量二氧化硫 NH3•H2O+SO2═NH4++HSO3- | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2═Fe3++2H2O |
分析 A.碘离子的还原性大于亚铁离子,氯气少量时碘离子优先反应;
B.次氯酸具有强氧化性,能够将亚硫酸钙氧化成硫酸钙;
C.二氧化硫过量,反应生成亚硫酸氢铵;
D.离子方程式两边正电荷不相等,违反了电荷守恒.
解答 解:A.碘化亚铁溶液中通入少量氯气,碘离子优先反应,正确的离子方程式为:2I-+Cl2═I2+2Cl-,故A错误;
B.次氯酸能够氧化亚硫酸钙,正确的离子方程式为:Ca2++3ClO-+H2O+SO2═CaSO4↓+2HClO+Cl-,故B错误;
C.用氨水吸收过量二氧化硫,反应生成亚硫酸氢铵,反应的离子方程式为:NH3•H2O+SO2═NH4++HSO3-,故C正确;
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液,二者发生氧化还原反应生成铁离子和水,正确的离子方程式为:2Fe2++2H++H2O2═2Fe3++2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


科目:高中化学 来源: 题型:选择题
| A | 分别滴入几滴水,触摸试管底部 | 1热 ②变凉 |  |
| B | 分别加10mL水,振荡 | ①、②均完全溶解 | |
| C | 分别加10mL水,滴入酚酞 | ①变红 ②变浅红 | |
| D | 分别用铂丝蘸取少量,进行焰色反应 | ①、②火焰均为黄色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5L0.1mol/L NH3•H2O | B. | 0.1L0.2mol/L 盐酸 | ||
| C. | 5L0.1mol/L 醋酸溶液 | D. | 0.1L0.1mol/LNaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
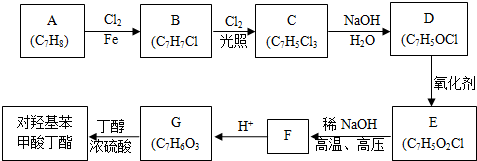 对羟基甲苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得.:
对羟基甲苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得.: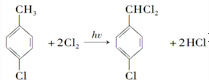 ,
, ;
;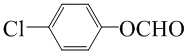 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2中所含质子数、中子数均为2NA | |
| B. | 46g NO2气体和46g N2O4气体的分子数之比为2:1 | |
| C. | 1L 1 mol•L-1的盐酸中所含粒子总数为2NA | |
| D. | 71g氯气与足量铁粉充分反应,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若铜有剩余,则向反应后的溶液中再滴加硫酸,铜也不能溶解 | |
| B. | 若金属全部溶解,则反应后的溶液中一定含有Cu2+、Fe3+离子 | |
| C. | 若铁粉全部转化为Fe2+离子,则b的值为0.8 | |
| D. | 若反应后的溶液中n(Fe3+):n(Fe2+)=3:2,则产生的NO为5152 mL(标准状况) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com