


科目:高中化学 来源:不详 题型:单选题
| A.0.8 mol | B.1.1 mol | C.1.2 mol | D.2.0 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化产物为Cl2 |
| B.参加反应的氧化剂与还原剂的物质的量之比为1∶2 |
| C.若有3 mol H2O生成,则反应中有2 mol电子转移 |
| D.当该反应生成2.24 L Cl2(标准状况)时,反应中有0.1 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.8.64 g | B.9.20 g |
| C.9.00 g | D.9.44 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaNO2既具有氧化性又具有还原性 |
| B.食用“醋溜豆芽”可能会减少亚硝酸钠对人体的危害 |
| C.NaNO2和胃酸作用的离子方程式为: 2NO2—+2H+=NO↑+NO2↑+H2O |
| D.1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.100mL | B.160mL | C.240mL | D.307mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.34 mol | B.0.38 mol |
| C.0.28 mol | D.0.2 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
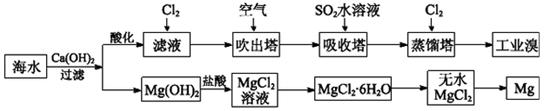
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com