
【题目】大气污染物主要成分是SO2、NO2、NO、CO及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气,会导致雾霾、酸雨等。
(1)汽车的三元催化转化器中,在催化剂作用下NO和CO转化为无毒气体,反应的化学方程式是: 2CO+2NO ![]() 2CO2+N2,该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式),当生成2mol N2时,转移电子的物质的量是____________________。
2CO2+N2,该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式),当生成2mol N2时,转移电子的物质的量是____________________。
(2)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2转化为SO42―。已知0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,则反应的离子方程式是______________________。
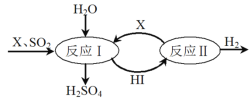
(3)SO2通过如图过程既能制得H2SO4又能制得H2。图中可循环利用的物质X是_________(填化学式),制得H2SO4的化学方程式是__________________________。
(4)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:NO2+NO+2NaOH===2NaNO2+H2O 2NO2+2NaOH===NaNO2+NaNO3+H2O
现有V L某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。所用烧碱溶液的物质的量浓度至少为________ mol·L1。若所得溶液中c(![]() )∶c(
)∶c(![]() )=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____________________。
)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____________________。
【答案】NO CO2 8mol ClO-+SO2+H2O=SO42-+Cl-+2H+ I2 SO2+I2+2H2O= H2SO4+2HI ![]() 3∶2
3∶2
【解析】
(1)化学反应中元素化合价降低的做氧化剂被还原生成还原产物,元素化合价升高的做还原剂被氧化生成氧化产物,结合化学方程式定量关系计算电子转移总数;
(2)NaClO溶液吸收烟气中SO2,发生氧化还原反应生成硫酸和氯化钠,结合电荷守恒和原子守恒书写离子方程式;
(3)反应Ⅰ是碘单质与二氧化硫反应生成硫酸和氢碘酸,反应的化学方程式为:Br2+SO2+2H2O=2HBr+H2SO4,反应Ⅱ是氢碘酸分解生成氢气和碘单质,2HBr![]() Br2+H2;
Br2+H2;
(4)①根据气体和氢氧化钠的关系式计算;
②根据二氧化氮、一氧化氮和氢氧化钠反应的方程式中各个物理量之间的关系式计算;
(1)反应的化学方程式是:2CO+2NO ![]() 2CO2+N2,氮元素化合价+2价降低为0价,NO做氧化剂,CO做还原剂被氧化得到氧化产物CO2,
2CO2+N2,氮元素化合价+2价降低为0价,NO做氧化剂,CO做还原剂被氧化得到氧化产物CO2,
故答案为:NO,CO2;
反应的化学方程式是:2CO+2NO![]() 2CO2+N2,元素化合价变化计算生成1mol氮气电子转移4e-,当生成2mol N2时,转移电子的物质的量是8mol,
2CO2+N2,元素化合价变化计算生成1mol氮气电子转移4e-,当生成2mol N2时,转移电子的物质的量是8mol,
故答案为:8mol;
(2)NaClO溶液吸收烟气中SO2,0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,物质的量比为1:1,发生氧化还原反应生成硫酸和氯化钠,反应的离子方程式是:SO2+ClO-+H2O═SO42-+Cl-+2H+,
故答案为:SO2+ClO-+H2O═SO42-+Cl-+2H+;
(3)由图可知反应Ⅰ是碘单质与二氧化硫反应生成硫酸和氢碘酸,反应Ⅱ是氢碘酸分解生成氢气和碘单质,该过程可循环利用的物质是I2和HI,X为I2
故答案为:I2;
②反应Ⅰ是碘单质与二氧化硫反应生成硫酸和氢碘酸,反应的化学方程式:SO2+I2+2H2O═H2SO4+2HI,
故答案为:SO2+I2+2H2O═H2SO4+2HI;
(4)根据方程式2NO2+2NaOH=NaNO2+NaNO3+H2O和NO2+NO+2NaOH=2NaNO2+H2O知,只要NO不剩余,氮原子和氢氧化钠的关系式是1:1,所以完全吸收n mol NO2和m mol NO组成的混合气体所用氢氧化钠的物质的量等于氮氧化物的物质的量之和,所以n(NaOH)=![]() ,
,
故答案为:![]() ;
;
设原混合气体中NO2和NO的物质的量n和m,
NO2+NO+2NaOH=2NaNO2+H2O,
1 1 2
mmol mmol 2mmol
2NO2+2NaOH=NaNO2 + NaNO3+H2O,
2 1 1
(n-m)mol ![]() mol
mol ![]() mol
mol
所得溶液中c(NO3-):c(NO2-)=![]() mol:[2m+
mol:[2m+![]() mol]=1:9,
mol]=1:9,
所以n:m=3:2,
故答案为:3:2;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图,下列说法不正确的是
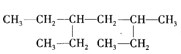
A.该有机物属于饱和链烃
B.该烃的名称是2,4-二乙基己烷
C.该烃与2,5-二甲基-3-乙基己烷互为同分异构体
D.该烃的一氯代物共有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单萜类化合物香叶醇是香精油的主要成分之一。在酸性溶液中,香叶醇可以转化为环状单萜α—松油醇:
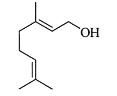
![]()
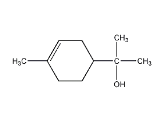
关于香叶醇和α—松油醇,下列说法正确的是( )
A.香叶醇能在铜丝催化下和氧气氧化生成醛,但α—松油醇不能
B.两者互为同分异构体,分子式是C10H20O
C.两者分子中所有原子均处于同一平面
D.两者均能使溴的四氯化碳溶液褪色,是发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向 100 mL 蒸馏水中滴入10 mL 5 mol·L-1HA溶液,利用传感器测得溶液中 c (H+)和温度随着加入 HA 溶液体积的变化曲线如图所示,下列有关说法正确的是
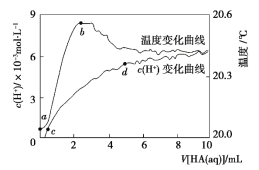
A.HA 是强酸
B.a ~ b 段,HA 电离放热,使溶液温度升高
C.c ~ d 段, c (H+)增大,HA 电离程度增大
D.c 点时,加入等体积等浓度的 NaOH 溶液,则 c (Na+)= c (A-)+ c (HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机合成在化工医药领域应用广泛,下图是一种新型药物合成路线。
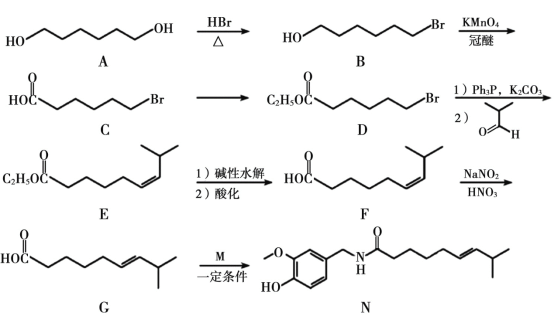
回答下列问题:
(1)A 的系统命名法(CCS)名称为________,D 中官能团的名称为________。
(2)B→C 的反应类型为________,从反应所得液态有机混合物中提纯 B 的常用方法为________。
(3)C→D 的化学方程式为________。C 和 D 在下列哪种检测仪上显示出的信号峰是完全相同的_________
A.元素分析仪 b.红外光谱仪 c.核磁共振仪 d.质谱仪
(4)C 的同分异构体 W(不考虑手性异构)可发生银镜反应,且 1 mol W 最多与 2 molNaOH 发生反应,产物之一可被氧化成二元醛,满足上述条件的 W 有________种。若 W 的核磁共振氢谱具有四组峰,则其结构简式为________。
(5)F 与 G 的关系为(填序号)________。
A.碳链异构 b.官能团类别异构 c.顺反异构 d.官能团位置异构
(6)M 的结构简式为________。
(7)参照上述合成路线,以![]() 和
和![]() 为原料制备医药中间体
为原料制备医药中间体![]() ,写出合成路线流程图_________________________________________________________________。
,写出合成路线流程图_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度和压强下,将等质量的CH4、CO2、O2、SO2四种气体分别吹入四个不同的气球,下列说法中正确的是( )

A.气球②中装的是O2
B.气球①和气球③中气体分子数相等
C.气球①和气球④中气体物质的量之比为4∶1
D.气球③和气球④中气体密度之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-具有还原性,含碘食盐中的碘元素主要以KIO3的形式存在,I-、I2、IO3-在一定条件下可发生如图转化关系。下列说法不正确的是
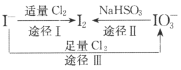
A.用淀粉-KI试纸和食醋可检验食盐是否加碘
B.由图可知氧化性的强弱顺序为C12>IO3->I2
C.生产等量的碘,途径I和途径Ⅱ转移电子数目之比为2:5
D.途径Ⅲ反应的离子方程式:3C12+I-+3H2O=6C1-+IO3-+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体(K3[Fe(C2O4)3]xH2O)(其中铁的化合价为+3价)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
Ⅰ.铁含量的测定
步骤1:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤2:取溶液25..00mL于锥形瓶中,酸化,滴加KMnO4溶液至草酸根(C2O42﹣)恰好全部被氧化成CO2,同时,MnO4﹣被还原成Mn2+;向反应后的溶液中加入锌粉至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤3:用0.010mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4﹣被还原成Mn2+。
重复步骤2、步骤3操作,滴定消耗0.010mol/LKMnO4溶液19.98mL。
请回答下列问题:
(1)步骤2中加入锌粉至黄色刚好消失,目的是_____。
(2)写出步骤3中发生反应的离子方程式_____。
(3)根据实验数据,测得该晶体中铁元素的质量分数为_____。
(4)若步骤2中加入的KMnO4溶液的量不足,则测得的铁含量_____(选填“偏低”“偏高”或“不变”)
Ⅱ.结晶水的测定
(5)采用热重分析仪测定三草酸合铁酸钾晶体K3[Fe(C2O4)3]xH2O在110℃时的失重率为a%,则晶体
化学式中结晶水个数x的计算式为_____。(用含a的代数式表示)(已知:三草酸合铁酸钾的摩尔质量M(K3[Fe(C2O4)3])=437g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下:
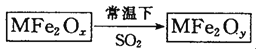
则下列判断正确的是( )
A.x>yB.MFe2Ox是还原剂C.SO2是该反应的催化剂D.SO2发生了置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com