
【题目】常温下,用 0.1 mol·L-1HCl溶液滴定10.0 mL浓度为0.1 mol·L-1 Na2CO3溶液,所得滴定曲线如如图所示。下列说法正确的是
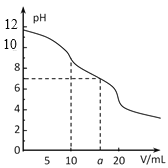
A.当V=0时:c(H+)+c(HCO 3-)+c(H2CO3)=c(OH-)
B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-)
C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3)
D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-)
【答案】BD
【解析】
A.当V=0时为碳酸钠溶液,根据电荷守恒可知:c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-),根据物料守恒可得:c(Na+)=2c(HCO3-)+2c(H2CO3)+2c(CO32-),根据电荷守恒和物料守恒可得:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-),故A错误;
B.当V=5时,碳酸钠与氯化氢浓度相等,则氯离子的物质的量为总的碳原子的物质的量一半,根据物料守恒可得:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-),故B正确;
C.当V=10时,此时恰好反应生成碳酸氢钠,碳酸氢钠溶液中碳酸氢根离子的水解大于其电离程度,则碳酸的浓度大于碳酸根离子,即c(CO32-)<c(H2CO3),正确的离子浓度大小关系为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故C错误;
D.V=a时,溶液为中性,c(H+)=c(OH-),根据电荷守恒可得:c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(Cl-)+c(HCO3-),则c(Na+)=2c(CO32-)+c(HCO3-)+c(Cl-),所以c(Na+)>c(Cl-)>c(H+)=c(OH-),故D正确;
答案选BD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,盐桥中装有饱和![]() 溶液。下列叙述中正确的是
溶液。下列叙述中正确的是

A. 甲烧杯中溶液的![]() 逐渐减小 B. 乙烧杯中发生还原反应
逐渐减小 B. 乙烧杯中发生还原反应
C. 外电路的电流方向是从![]() 到
到![]() D. 电池工作时,盐桥中的
D. 电池工作时,盐桥中的![]() 移向甲烧杯
移向甲烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O
探究一:用如图所示装置进行实验,回答下列问题:
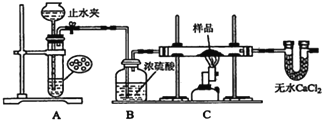
(1)仪器组装完成后,夹好止水夹,_____,则说明装置A的气密性良好.
(2)装置A是氢气的发生装置,可以选用的药品是________(填选项)
A.稀硫酸和锌片B.稀硝酸和铁片 C.氢氧化钠溶液和铝片D.浓硫酸和镁片
(3)从下列实验步骤中,选择正确的操作顺序:①________③(填序号).
①打开止水夹②熄灭C处的酒精喷灯 ③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯 ⑤收集氢气并验纯⑥通入气体一段时间,排尽装置内的空气
探究二:
(4)甲同学取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;乙同学认为观点不正确,其原因是_____________;丙同学另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体.证明样品中一定含有________,其反应的离子方程式为_____;丁同学预设计实验证明另一种物质是否存在,其方案为__________。
(5)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=_________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到预期目的是
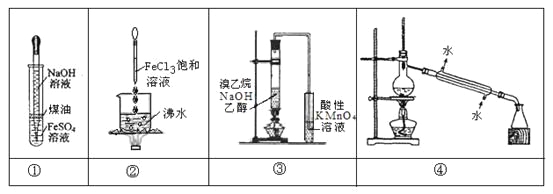
A.实验①:挤出胶头滴管中的NaOH溶液,观察Fe(OH)2沉淀的颜色
B.实验②:继续煮沸溶液至红褐色,停止加热,当光束通过体系时产生丁达尔效应
C.实验③:通过观察酸性KMnO4溶液紫色褪去,确认有乙烯生成
D.实验④:控制一定温度,将石油分离为汽油、柴油等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中粒子浓度的关系式中,正确的是

A.pH相同的①CH3COONa、②NaHCO3、③![]() 三份溶液中的c(Na+):③>②>①
三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.如图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.如图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从工业废钒中回收金属钒既避免污染环境又有利于资源综合利用。某工业废钒的主要成分为V2O5、VOSO4和SiO2等,下图是从废钒中回收钒的一种工艺流程:

(1)为了提高“酸浸”效率,可以采取的措施有________(填两种).
(2)“还原”工序中反应的离子方程式为________.
(3)“沉钒”得到NH4VO3沉淀,需对沉淀进行洗涤,检验沉淀完全洗净的方法是________.
(4)写出流程中铝热反应的化学方程式________.
(5)电解精炼时,以熔融NaCl、CaCl2和VCl2为电解液(其中VCl2以分子形式存在).粗钒应与电源的________极(填“正”或“负”)相连,阴极的电极反应式为________.
(6)为预估“还原”工序加入H2C2O4的量,需测定“酸浸”液中VO2+的浓度.每次取25.00mL“酸浸”液于锥形瓶用a mol/L(NH4)2Fe(SO4)2标准溶液和苯代邻氨基苯甲酸为指示剂进行滴定(其中VO2+ VO2+),若三次滴定消耗标准液的体积平均为bmL,则VO2+的浓度为________g/L(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是

A. 图中a和b分别为T1、T2温度下CdS在水中的溶解度
B. 图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C. 向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D. 温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
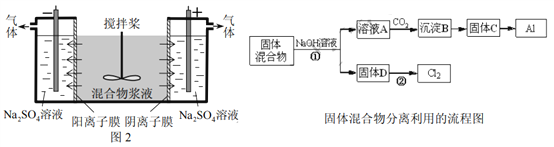
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是
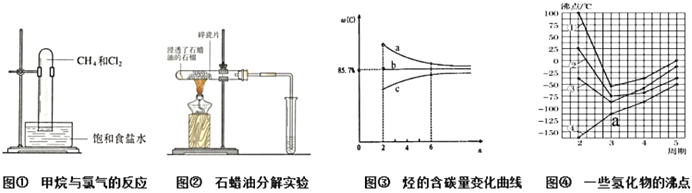
A. 图①:当CH4与Cl2体积比为1:2,维持足够长反应时间,CH4可全部变成CCl4
B. 图②:碎瓷片的作用与蒸馏实验中的碎瓷片作用不同
C. 图③:烷烃、烯烃、炔烃的单一物质及同类混合物含碳量随C原子数的变化曲线分别为a、b、c
D. 图④:点a代表的物质是PH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com