
【题目】下列生产过程属于物理变化的是( )
A.煤炭干馏B.煤炭液化C.石油裂化D.石油分馏
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:
【题目】锂离子电池是一种二次电池,它主要依靠锂离子在两极之间移动来工作.某锂离子电池正极材料有钴酸锂(LiCoO2)、铝箔和有机物导电剂等.现利用以下流程回收正极材料中的某些资源. 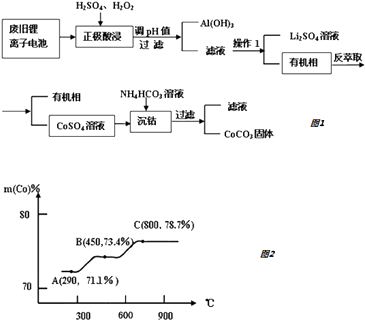
请回答下列问题:
(1)用硫酸和过氧化氢酸浸时,一般在90℃下进行,写出该步骤中LiCoO2参与的化学反应方程式 . 当有1mol LiCoO2参加反应时,得到氧化产物的质量为 .
(2)常温条件下调pH时,若使Al3+完全沉淀所需最小的pH为(保留整数).
(已知:①离子浓度等于或小于1.×10﹣6时,认为其完全沉淀; ②Al(OH)3的Ksp=1.13×10﹣33)
(3)操作1的名称是 .
(4)从平衡角度进行解释生成CoCO3固体的原因 .
(5)钴元素与铁元素都属于第 VIII族,它们的化合物有相似的性质.Co(OH)2在空气中加热时,钴元素在固体残留物中的百分含量有如右图所示的变化.已知钴的氢氧化物加热至290℃时已完全脱水,则A点时,剩余固体的成分为(填化学式);在550﹣600℃范围内,剩余固体的成分为(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断正确的是( )
A.铝粉在氧气中燃烧生成Al2O3 , 故铁丝在氧气中燃烧生成Fe2O3
B.铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜
C.活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中
D.钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属均作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3的氧化反应:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq)△H=m kJmol﹣1 . 其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段.
(1)已知O2(g)O2(aq)△H=nkJmol﹣1 , Na2SO3溶液与O2(g)反应的热化学方程式为
(2)291.5K时,1.0L溶液中Na2SO3初始量分别为4、6、8、12mmol,溶解氧浓度初始值为9.60mgL﹣1 , 每5s记录溶解氧浓度,实验结果如图.当Na2SO3的初始量为12mmol,经过20s溶解氧浓度降为6.40mgL﹣1 , 则0﹣20s内Na2SO3的平均反应速率为molL﹣1s﹣1
(3)为确定贫氧区速率方程v=kca(SO32﹣)cb(O2)中a,b的值(取整数),分析实验数据.
c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
①当溶解氧浓度为4.0mgL﹣1时,c(Na2SO3)与速率数值关系如表,则a=
②当溶解氧浓度小于4.0mgL﹣1时,图中曲线皆为直线,则b= ,
(4)两个阶段不同温度的速率常数(k)之比如表.
反应阶段 | 速率方程 |
|
富氧区 | v=kc(SO32﹣)c(O2) | 1.47 |
贫氧区 | v=kca(SO32﹣)cb(O2) | 2.59 |
已知ln ![]() =﹣
=﹣ ![]() (
( ![]() ),R为常数,Ea(富氧区)Ea(贫氧区)(填“>”或“<”).
),R为常数,Ea(富氧区)Ea(贫氧区)(填“>”或“<”).
(5)结合图表分析,Na2SO3初始量不同时,划分富氧区与贫氧区的溶解氧浓度是否相同,为什么?.
(6)一定温度下,化学反应速率仅与决速步的反应物浓度有关.Na2SO3氧化反应历程涉及的
①SO32﹣+O2→SO5﹣
②SO5﹣+SO32﹣→SO52﹣+SO3﹣
③SO32﹣+SO32﹣→SO3﹣+SO32﹣
④SO32﹣+O2→SO5﹣
⑤SO52﹣+SO32﹣→2SO42﹣
富氧区与和贫氧区的决速步分别是、(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸法钛白粉生产中的副产物(主要成分是绿矾、少量TiO2及重金属离子)制备高品质氧化铁红的工艺过程如图1: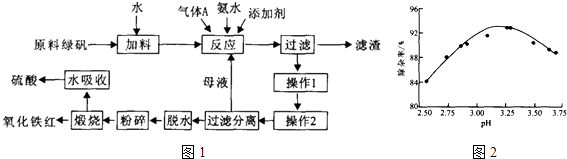
(1)原料绿矾需要加入铁粉进行预处理,其目的为(用离子方程式表示).
(2)利用氨水中和反应可以促进重金属离子水解,以便沉淀出去,如图为pH与除杂率的关系.气体A为(填化学式),调节pH适宜范围为 .
(3)操作1和操作2分别为
(4)绿矾通过脱水、锻烧等工序转化为氧化铁红.反应为:FeSO47H2O ![]() FeSO4H2O+6H2O↑:
FeSO4H2O+6H2O↑:
(5)该过程中可循环使用的物质为(填化学式).
(6)若生产1t钦白粉会产生3t含量为96.5%的绿矾原料,生产中损失5%,则高品质氧化铁红的产量为 t
(7)TiO2可用于制备海绵钛:
①已知:
(i)TiO2(g)+2C12(g)═TiC14(1)+O2(g)△H=+141kJmol﹣1
(ii)TiO2(g)+C(s)+2C12(g)═TiC14(1)+CO2(g)△H=﹣218kJmol﹣1
工业上采用(ii)制备TiC14 , 不能采用(i)的原因是 . 02Mg在高温下还原TiC14制备海绵钦的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔为原料在不同条件下可以合成多种有机物.
已知:①CH2═CH﹣OH(不稳定)![]() CH3CHO
CH3CHO
②一定条件下,醇与酯会发生交换反应:RCOOR′+R″OH![]() RCOOR″+R′OH
RCOOR″+R′OH
完成下列填空:
(1)B 中官能团名称 ;④的反应类型
(2)⑤的反应条件
(3)③的化学方程式
(4)D 的同分异构体中含碳碳双键、能发生银镜反应且属于酯的共有 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,m g A气体与n g B气体分子数相等,下列说法不正确的是( )
A.标准状况下,同体积的气体A和气体B的质量比m:n
B.25℃时,1kg气体A与1kg气体B的分子数之比为n:m
C.同温同压下,气体A与气体B的密度之比为m:n
D.标准状况下,等质量的A与B的体积比为m:n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据如图实验装置回答问题. 
(1)仪器①~④中,使用时必须检查是否漏水的是(填序号).
(2)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器 , ②的进水口是(填“f”或“g”).
(3)某小组同学欲配制230mL 0.4mol/L 盐酸,则需取用4mol/L盐酸mL.
(4)装置Ⅱ是该小组某同学转移溶液的示意图,指出图中的错误之处: ①;② .
(5)下列实验操作使配制的溶液浓度偏低的是 .
A.容量瓶洗涤后未干燥
B.移液时,有少量溶液溅出
C.定容时,加水不慎超过刻度线,又倒出一些
D.量筒量取溶液时,仰视刻度线
E.装入试剂瓶时,有少量溶液溅出.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com