
分析 (1)含硫酸根离子的盐为硫酸盐;
(2)H++OH-═H2O,表示可溶性强酸或者强酸的酸式盐与可溶性强碱反应生成可溶性盐和水;
(3)硫酸铝为强电解质,电离生成铝离子和硫酸根离子;结合n=$\frac{m}{M}$=cV计算离子浓度;
(4)氢氧化钡与硫酸氢钠按照物质的量之比1:1反应,硫酸根离子恰好沉淀完全;
(5)在参加反应的8mol硝酸中,被还原的硝酸的物质的量为2mol,生成NO的物质的量是2mol,转移电子是6mol.
解答 解:(1)盐中含硫酸根离子的为硫酸盐,⑤NaHSO4 固体和⑩Al2(SO4)3属于硫酸盐,故答案为:⑤⑩;
(2)H++OH-═H2O,表示可溶性强酸或者强酸的酸式盐与可溶性强碱反应生成可溶性盐和水,可以表示氢氧化钡与硝酸的反应,方程式:Ba(OH)2+2HNO3═Ba(NO3)2+2H2O;
故答案为:Ba(OH)2+2HNO3═Ba(NO3)2+2H2O;
(3)硫酸铝是强电解质,能完全电离,电离方程式为:Al2(SO4)3=2Al3++3SO42-,17.1gAl2(SO4)3溶于水配成250mL溶液,SO42-的物质的量为$\frac{17.1g}{342g/mol}$=0.05mol,SO42-的物质的量浓度c=$\frac{n}{V}$=$\frac{0.05mol}{0.250L}$=0.6mol/L,
故答案为:Al2(SO4)3=2Al3++3SO42-,0.6mol/L;
(4)氢氧化钡与硫酸氢钠按照物质的量之比1:1反应,硫酸根离子恰好沉淀完全,离子方程式:H++SO42-+Ba2++OH-═BaSO4↓+H2O;
故答案为:H++SO42-+Ba2++OH-═BaSO4↓+H2O;
(5)在参加反应的8mol硝酸中,被还原的硝酸的物质的量为2mol,生成NO的物质的量是2mol,转移电子是6mol,若反应中转移了0.6mol电子,产生的气体的物质的量是0.2mol,在标准状况下的体积是0.2mol×22.4L/mol=4.48L.
故答案为:4.48.
点评 本题考查了考查物质的分类、离子反应方程式的书写、电离方程式的书写、氧化还原反应电子守恒计算、气体体积的计算等知识,明确电解质概念,熟悉以物质的量为核心计算公式是解题关键,侧重考查学生分析和解决问题的能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 固体2是氧化铁 | |
| B. | X的化学式可以表示为Fe3C2 | |
| C. | 溶液甲中可能含有Fe3+ | |
| D. | X与足量的热浓硝酸反应有NO2和CO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的氢化物的水溶液能与W的钠盐溶液,反应得到W的氢化物,说明非金属性M>W | |
| B. | X和Y形成的原子个数比为1:1的分子中极性键和非极性键之比为2:1 | |
| C. | Z元素在自然界中存在游离态 | |
| D. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与醋酸钠溶液中的醋酸根均可以水解,同浓度时前者的水解程度比后者低一些 | |
| B. | 明矾净水与自来水的杀菌清毒原理是相同的 | |
| C. | MgO和Al2O3常用于制作耐高温材料,工业上采用电解此两种物质冶炼镁、铝金属 | |
| D. | 氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10种 | B. | 9种 | C. | 8种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖溶液能产生丁达尔效应 | B. | 福尔马林可用于食品的防腐保鲜 | ||
| C. | 医用酒精可用于饮用水消毒 | D. | 淀粉、油脂、蛋白质可提供营养 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
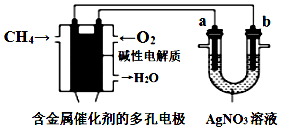
| A. | 电子经导线流入b电极 | |
| B. | 若b极增重5.4 g时,燃料电池负极消耗CH4的体积为140 mL | |
| C. | 燃料电池中正极反应为O2+4e-+2H2O═4OH- | |
| D. | 此装置用于电镀银时,一段时间后硝酸银溶液的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
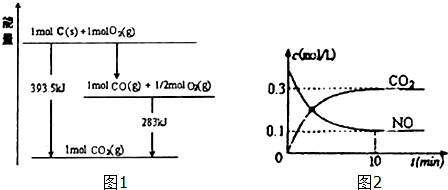
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 1.7×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com