
【题目】下列关于胶体的叙述中,不正确的是( )
A.![]() 胶体能吸附水中的悬浮颗粒并沉降,常用于净水
胶体能吸附水中的悬浮颗粒并沉降,常用于净水
B.浊液、胶体、溶液的本质区别是分散质粒子的直径大小
C.用激光笔照射![]() 溶液和
溶液和![]() 胶体时,产生的现象相同
胶体时,产生的现象相同
D.胶态磁流体治癌术是将磁性物质制成胶体粒子,这种粒子的直径在![]() 之间
之间![]()
【答案】C
【解析】
A.氢氧化铁胶体具有吸附性,能吸附水中悬浮颗粒并沉降,常用于净水,故A正确;
B.分散质粒子的大小不同是分散系的本质区别,分散质微粒直径,小于1nm的形成分散系为溶液,大于100nm为浊液,1-100nm的为胶体,故B正确;
C.胶体具有丁达尔效应,而溶液没有,据此可区分胶体和溶液,所以用激光笔照射![]() 溶液和
溶液和![]() 胶体时,胶体中会出现光亮的通路,产生的现象不同,故C错误;
胶体时,胶体中会出现光亮的通路,产生的现象不同,故C错误;
D.分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),胶态磁流体治癌术是将磁性物质制成胶体粒子,这种粒子的直径应在1nm-100nm之间,故D正确;
故答案为C。


科目:高中化学 来源: 题型:
【题目】香叶醇是合成玫瑰香油的主要原料,其结构简式如下:
![]()
下列有关香叶醇的叙述正确的是( )
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能燃烧,其产物一定为二氧化碳和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是( )
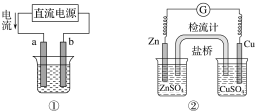
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)亚硝酰氯(Cl—N=O)气体是有机合成的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为__。
相关化学键的键能如下表所示:
化学键 | Cl—Cl | N | Cl—N | N=O |
键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(CO2)=___mol·L-1·min-1;当升高温度,该反应的平衡常数K__(填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是__(填字母)。
A.加入一定量的粉状碳酸钙
B.适当缩小容器的体积
C.通入一定量的O2
D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
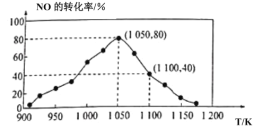
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为__。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=__[已知:气体分压(P分)=气体总压(Pa)×体积分数]
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅降低温度,k正减小的倍数_(填“>”、“<”或“=”)k逆减小的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为20%,则![]() =__(计算结果用分数表示)
=__(计算结果用分数表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I是制备预防髋或膝关节置换术后静脉血栓栓塞药物的医药中间体。其一种合成路线如图:
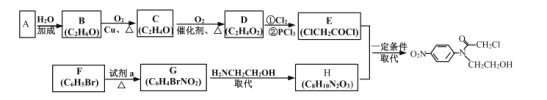
请回答下列问题:
(1)G中官能团的名称为__;C的化学名称为__。
(2)C→D的反应类型为__。
(3)F→G所需的试剂![]() 为__。
为__。
(4)G→H的化学方程式为__。
(5)M为H的同分异构体,同时满足下列条件的M有__种(不考虑立体构);其中核磁共振氢谱显示6种不同环境的氢,且峰面积之比为1:1:1:1:2:4的结构简式为__(写出任意一种)。
①苯环上有三个取代基且其中两个为氨基
②1molM分别与足量Na或NaHCO3溶液反应,均能产生气体且生成气体的物质的量相同。
(6)参照上述流程和信息,设计以甲苯和H2NCH2CH2OCH2COCl为原料(无机试剂任选)制备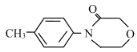 的合成路线:__。
的合成路线:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.常温下,pH=13的NaOH溶液中含有的OH-数目为0.1NA
B.100mL12mol·L-1浓硝酸与过量Cu反应转移电子的数目为0.6NA
C.电解精炼铜时,若阳极质量减少64g,则阴极得到电子的数目为2NA
D.14g聚丙烯中含C—H键总数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过反应:Al2O3+3C+3Cl2 ![]() 2AlCl3+3CO 制取无水氯化铝,下列关于该反应的说法正确的是
2AlCl3+3CO 制取无水氯化铝,下列关于该反应的说法正确的是
A.Al2O3是氧化剂B.CO是氧化产物
C.每生成1 mol AlCl3,转移3个电子D.C发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.50 g 34%H2O2溶液中含H-O键的数目为NA
B.180 g淀粉完全水解生成葡萄糖的分子数为NA
C.1 L 0.1 mol·L-1K2SiO3溶液中含SiO32-的数目为0.1NA
D.反应5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O,每生成1 mol ClO2转移电子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氨的叙述中不正确的是( )
A. 氨分子中氮元素的化合价只能升高,氨具有还原性
B. 氨的催化氧化反应的化学方程式是4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C. 氨的催化氧化反应中若氧气过量则有红棕色气体生成
D. 氨的催化氧化属于人工氮的固定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com