
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔点、沸点随核电荷数的增加而增大 | |
| C. | 它们的气态氢化物的热稳定性随核电荷数的增加而减小 | |
| D. | 它们的气态氢化物的还原性随核电荷数的增加而减小 |
分析 F、Cl、Br、I位于周期表同一主族,原子序数逐渐增大,原子核外电子层数逐渐增加,半径逐渐增大,熔沸点随核电荷数的增加而增加;元素的非金属性逐渐减弱,则对应氢化物的稳定性质逐渐减弱,但颜色逐渐加深.
解答 解:A、卤族元素单质从F到I,其颜色分别为:淡黄绿色、黄绿色、深红棕色、紫红色,所以卤族元素单质的颜色随着核电荷数增大而加深,故A正确;
B、F、Cl、Br、I位于周期表同一主族,它们的熔沸点随核电荷数的增加而增加,故B正确;
C、元素的非金属性越强,其气态氢化物的稳定性越强,从F到I,其非金属性随着核电荷数增大而减弱,所以其气态氢化物的稳定性逐渐减弱,故C正确;
D、元素的非金属性越强,离子的还原性越弱,从F到I,其非金属性随着核电荷数增大而减弱,所以它们的气态氢化物的还原性随核电荷数的增加而增强,故D错误.
故选D.
点评 本题考查了卤族元素结构和性质的关系,结构决定性质,根据结构分析其性质,熟练掌握元素周期律知识,题目难度不大.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:解答题
 醋酸亚铬水合物{[Cr(CH3COO)2)]2•2H2O,深红色晶体}是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,易溶于乙醇和盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物{[Cr(CH3COO)2)]2•2H2O,深红色晶体}是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,易溶于乙醇和盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚氨基锂(Li2NH)中N的化合价为-1 | |
| B. | 此法储氢和钢瓶储氢的原理相同 | |
| C. | Li+和H-的半径相同 | |
| D. | 该反应中氢气既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子间作用力无一定方向性 | B. | 占据晶格结点的微粒是原子 | ||
| C. | 化学键是共价键 | D. | 三者都是 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的原子结构示意图: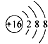 | |
| B. | NH4Cl的电子式: | |
| C. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm为不同的核素,有不同的化学性质 | |
| D. | 在固态水中,水分子间以氢键结合成排列规整的晶体,在这种晶体中有空隙,造成体积膨胀,密度减小至低于水的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 得到碘酸钾晶体,你建议的方法是蒸发结晶.
得到碘酸钾晶体,你建议的方法是蒸发结晶.| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com