
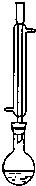 氯化苄(C6H5CH2Cl)是一种重要的有机化工原料,广泛应用于医药、染料、助香料等有机化工产品的制备.氯化苄为无色液体,具有强烈的催泪作用,沸点为179.4℃,不溶于水,可混溶于乙醇、氯仿等多数有机溶剂.工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄.为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品进行纯度检测.每一组检测按照如下步骤进行:
氯化苄(C6H5CH2Cl)是一种重要的有机化工原料,广泛应用于医药、染料、助香料等有机化工产品的制备.氯化苄为无色液体,具有强烈的催泪作用,沸点为179.4℃,不溶于水,可混溶于乙醇、氯仿等多数有机溶剂.工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄.为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品进行纯度检测.每一组检测按照如下步骤进行:

科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学取一定量的Al和Fe固体混合物,与2.0L极稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
某同学取一定量的Al和Fe固体混合物,与2.0L极稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com