
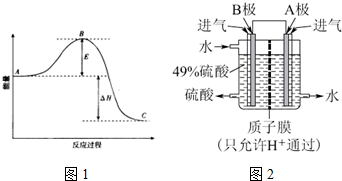
分析 (1)A、C分别表示反应物总能量的生成物总能量,B为活化能,活化能的大小与反应热无关;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比;
(3)V2O5氧化SO2时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成V2O5;
(4)本题为SO2与O2反应生成SO3,SO3再与水化合生成硫酸,根据硫酸的出口判断正负极,负极发生氧化反应,正极发生还原反应,原电池放电时,电解质溶液中阳离子向正极移动.
解答 解:(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,
故答案为:反应物总能量;生成物总能量;无;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1,
故答案为:-198;
(3)V2O5氧化SO2时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成V2O5,该催化循环机理的化学方程式为SO2+V2O5═SO3+2VO2、4VO2+O2═2V2O5,
故答案为:SO2+V2O5=SO3+2VO2;4VO2+O2=2 V2O5 ;
(4)该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,正极上投放的气体是氧气,正极上氧气得电子和氢离子反应生成水,根据硫酸和水的出口方向知,B极是负极,A极是正极,所以B极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,原电池放电时,氢离子由负极B移向正极A,所以其电池反应式为:2SO2+O2+2H2O=2H2SO4,
①根据硫酸和水的出口方向知,B极是负极,B极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:负极;SO2-2e-+2H2O=SO42-+4H+;
②原电池放电时,电解质溶液中H+通过质子膜由负极B移向正极A,向右移动,
故答案为:向右;
③正极A上氧气得电子和氢离子反应生成水,B电极反应为:O2+4H++4e-=2H2O,极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,所以其电池反应式为:2SO2+O2+2H2O=2H2SO4,
故答案为:2SO2+O2+2H2O=2H2SO4 ;
点评 本题考查反应过程的能量变化图以及运用盖斯定律进行反应热的计算、原电池原理和电极反应书写、催化剂的催化原理等知识点,难度不大,注意活化能与反应热的关系.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
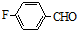 的名称对氟苯甲醛.
的名称对氟苯甲醛.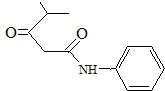 .
.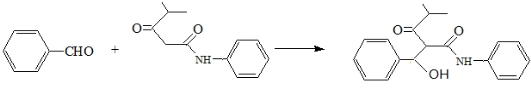 .
.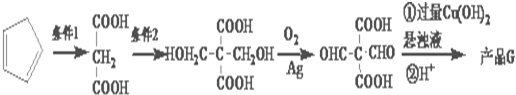
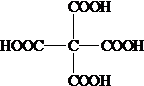 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
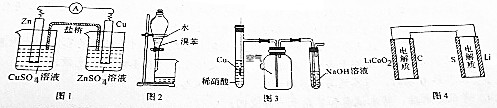
| A. | 图1装置设计铜锌双液原电池 | |
| B. | 图2装置用于分离水和溴苯的混合物 | |
| C. | 图3装置用于制备并收集NO气体 | |
| D. | 图4装置锂硫电池(2Li+S$?_{充电}^{放电}$Li2S)给锂离子电池充电(LixC+Li1-xCo2$?_{充电}^{放电}$C+LiCoO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
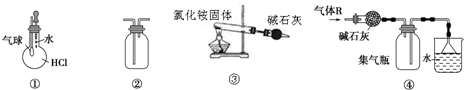
| A. | 装置①可验证HCl气体在水中的溶解性 | |
| B. | 装置②可用排空气法收集H2、NH3、Cl2、HCl、CO2等气体 | |
| C. | 装置③实验室用氯化铵制少量氨气 | |
| D. | 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含有3mol的FeI2溶液中通入标准状况下89.6L 氯气:2Fe2++6I-+4Cl2═2Fe3++3I2+8Cl- | |
| B. | 向铜片中滴加18.4mol/L的浓硫酸并加热:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 向氯化银浊液中加入Na2S溶液:2AgCl+S2-═Ag2S+2Cl- | |
| D. | 向NaAlO2溶液中滴加NaHCO3溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂是改变化学反应速率最有效的手段之一,使用催化剂可以带来巨大的经济效益 | |
| B. | 能量是可以互相转化的.植物的光合作用可将太阳能转变成化学能,太阳能电池可将光能转变成电能.原电池和电解池可实现化学能和电能的相互转换 | |
| C. | 有机高分子合成为人类提供了大量的新材料,聚氯乙烯、有机玻璃、腈纶、酚醛树脂等都属于合成高分子材料,都是通过加聚反应得到的 | |
| D. | 计算机技术的发展,使化学研究进入了分子水平,分子设计的思想为合成人类需要的新物质开辟了更广阔的道路 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com