
【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | 69 | 25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) 2C(s)+O2(g)=2CO(g)
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的化学方程式:________________
② 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是_____________________。
③ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
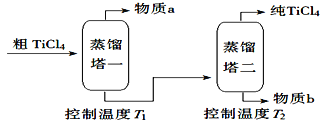
物质a是_________,T2应控制在_________
【答案】 TiO2+2Cl2+2C=TiCl4+2CO H2O、FeCl2溶液、NaOH溶液 MgCl2、AlCl3、FeCl3 SiCl4 高于136℃,低于181℃
【解析】考查化学工艺流程,(1)①根据信息,TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g),2C(s)+O2(g)=2CO(g) ,两式相加得到:TiO2+2Cl2+2C=TiCl4+2CO;②因为HCl极易溶于水得到盐酸,根据实验目的,因此先通过H2O,然后通过FeCl2溶液,让氯气把FeCl2氧化成FeCl3,可能有部分Cl2为反应,氯气有毒,必须尾气处理,最后通过NaOH溶液;③根据表格中数据,室温下,SiCl4、TiCl4为液体,SiCl4完全溶于TiCl4中,AlCl3、FeCl3、MgCl2为固体,少量的三种物质溶于TiCl4中,因此滤渣中含有AlCl3、FeCl3、MgCl2;(2)粗TiCl4中含有SiCl4杂质,因此物质a为SiCl4,根据流程目的,为了得到纯净TiCl4,温度应控制在稍微大于136℃,但小于181℃。


科目:高中化学 来源: 题型:
【题目】分析细胞内4种重要有机物的组成及功能,回答下列问题:
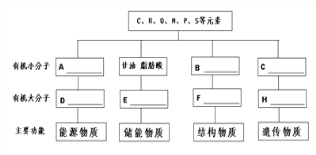
(1)A一般是指_____________;D在动物细胞中是指__________。
(2)E 是指_____________,它还有___________________的功能。
(3)B是指____________,其结构通式是______________,B形成[F]_________ 的过程叫____________。
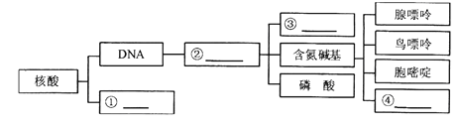
(4)如图中,是指______________,②是指______________,其中③是指___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新泽茉莉醛是一种名贵的香料.其合成路线如下:
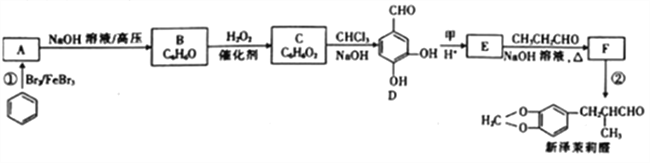
已知:①RCHO+R'CH2CHO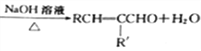
②
(1)已知甲的相对分子质量为30,甲的结构简式为____。E中含氧官能团的名称是____。
(2)反应②的反应类型是____ 。
(3)写出反应①的化学方程式:_________________。
(4)芳香族化合物G与E互为同分异构体,1molG能与足量NaHCO3溶液反应产生1mol气体,且G能发生银镜反应。则G的结构有______种。其中一种结构苯环上的一氯代物有两种,且被氧化后能与C反应生成高分子化合物,写出该高分子化合物的结构简式:_______。
(5)结合已知①,设计以乙醇和苯甲醛![]() 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备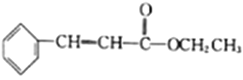 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
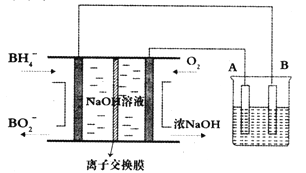
A. 离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
B. 该燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O
C. 电解池中的电解质溶液可以选择CuSO4溶液
D. 每消耗2.24LO2(标准状况)时,A电极的质量减轻12.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是重要的催化剂和化工原料,工业上制备Cu2O的主要反应如下:
Ⅰ.C(g)+CO2(g)![]() 2CO(g) ΔH=+172.5kJ/mol
2CO(g) ΔH=+172.5kJ/mol
Ⅱ.CO(g)+2CuO(s)![]() Cu2O(s)+CO2(g)ΔH=-138.0KJ/mol
Cu2O(s)+CO2(g)ΔH=-138.0KJ/mol
请回答:
(1)C与CuO反应生成Cu2O和CO的热化学方程式为_____________,一定温度下,该反应在密闭容器中达到平衡后,只增大容器的容积,再次达到平衡时,CO的平衡浓度_________(填“增大”、“减小”或“不变”)。
(2)一定温度下,向5L恒容密闭容器中加入1molCO和2molCuO,发生反应Ⅱ.5min时达到平衡,测得容器中CuO的物质的量为0.8mol。
①0-5min内,用CO2表示的反应速率v(CO2)=___________.
②CO的平衡转化率a=____________.
(3)向5L密闭容器中加入1molC和1molCO2,发生反应Ⅰ。 CO2、CO的平衡体积分数(φ)与温度(T)的关系如图所示。
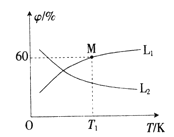
①能表示CO2的平衡体积分数与温度关系的曲线为___________(填"L1”或“L2”),理由为________。
②温度为T1时,该反应的平衡常数K=_____________。
(4)其他条件不变时,若水的分解反应用Cu2O作催化剂,则该反应的活化能_____(填“增大”、“减小”或“不变”,下同), 反应热(ΔH)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜阳极泥是有色金属冶炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下:
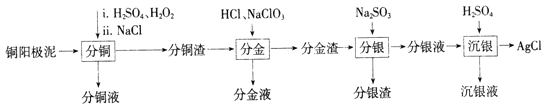
已知:分金液的主要成分为[AuCl4]-;分金渣的主要成分为AgCl和PbSO4;分银液中主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-。
Ag++2SO32-。
(1)①“分铜”时,单质铜发生反应的化学方程式为________;反应过程中需控制适当温度,温度不宜过高或过低的原因为_______。
②已知“分铜”时 各元素的浸出率如下表所示。
Cu | Au | Ag | |
浸出率/% | 85.7 | 0 | 4.5 |
“分铜”时加入足量的NaCl的主要作用为__________
(2)“分金”时,单质金发生反应的离子方程式为___________。
(3)“沉银”时,需加入硫酸调节溶液的pH=4。已知: ![]() ,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
,其中X表示SO32-、HSO3-或H2SO3,δ(x)与PH的关系如图所示。
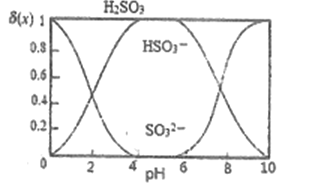
①分析能够析出AgCl的原因为_________
②调节溶液的PH不能过低,理由为__________
(4)“沉银液”加碱调至pH=8.0,Na2SO3可再生并循环利用,其再生原理为____(用离子方程式表示)。
(5)已知离子浓度≤10-5mol/L时,认为该离子沉淀完全;Ksp[Pb(OH)2]=2.5×10-16.
Ksp[Sb(OH)3])=10-41. 浸取“分银渣”可得到含0.025mol/L Pb2+的溶液( 含少量Sb3+杂质)。欲获得较纯净的Pb2+溶液,调节PH的范围为________。 (忽略溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氣(ClNO)常用作催化剂和合成洗涤剂,其沸点为-5.5℃,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,进行如下实验(夹持装置略去)。请回答:

Ⅰ.Cl2的制备
(1)Cl2的发生装置可以选择上图中的____________(填大写字母),反应的离子方程式为__________.
(2)欲收集一瓶干燥的氯气,选择上图中的装置,其连接顺序为:a![]() _____(按气流方向,用小写字母表示)。
_____(按气流方向,用小写字母表示)。
Ⅱ.亚硝酰氯(ClNO)的制备。实验室可用下图装置制备亚硝酰氯(ClNO);
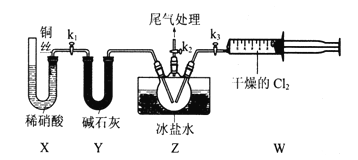
(3)实验室也可用B装置制备NO,与之相比X装置的优点为_______.
(4)在检查完装置气密性,并装入药品后,打开k2,然后再打开________(填“k1”"或“k3”),通入一段时间气体,其目的为_________。接下来,两种气体在Z中反应,当有一定量液体生成时,停止实验。
Ⅲ.亚硝酰氯(ClNO)纯度的测定
取Z中所得液体mg溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4。溶液为指示剂,用c mol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。(已知:Ag2CrO4为砖红色固体)
(5)亚硝酰氯(ClNO)与水反应的化学方程式为___________.
(6)亚硝酰氯(ClNO)的质量分数为_________(用代数式表示即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某元素M,其离子M2+,M2+原子核核内有20个中子,核外有18个电子,则M的质子数是__________,质量数是_________
(2)根据下列叙述,写出微粒符号和结构示意图。
a.原子核外有2个电子层,核外有10个电子的原子________、______________;
b.质量数为24,质子数等于中子数的原子_________、__________________;
c.最外层电子数是次外层电子数的4倍的二价阴离子_________、_________________。
(3)结构示意图为 的阳离子,其电子式符号可能为________、________、________。
的阳离子,其电子式符号可能为________、________、________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com