
 +H2
+H2
分析 (1)由乙醇在浓硫酸、加热条件下制乙烯,需要垫石棉网加热,防止受热不均;乙醛的银镜反应温度不宜过高,需要在水浴中反应;
(2)有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应;
消去反应是指在一定条件下,有机物脱去小分子物质,同时生成含有不饱和键的有机物的反应;
(3)①烯烃命名:含有碳碳双键的最长连为主链,从距离碳碳双键最近的一端编碳号,指明取代基、碳碳双键位置;
②一元醇醇的命名:含有羟基的最长连为主链,从距离羟基最近的一端编碳号,指明取代基、羟基键位置;
(4)由结构可知,两个相同的环在顶点位置提供CH2连接,环上C原子连接1个H原子,n个环有个顶点,故分子中C原子数目为3n,H原子数目为2n+2n=4n,故组成通式为C3nH4n(n≥3).
解答 解:(1)由乙醇在浓硫酸、加热条件下制乙烯,需要垫石棉网加热,防止受热不均;乙醛的银镜反应温度不宜过高,需要在水浴中反应,故答案为:B;C;
(2)①Fe+2HCl=FeCl2+H2↑,属于置换反应,不是有机反应,故不选;
②CH2=CHCH3+Cl2→CH2=CHCH2Cl+HCl,属于取代反应,故不选;
③2CH3CH2OH→CH3CH2OCH2CH3+H2O,属于取代反应,故不选;
④CH3CH2Br+NaOH→CH2=CH2+NaBr+H2O,属于消去反应,选不选,
⑤2CH3CHO+O2→CH3COOH+H2O,属于氧化反应,故选,
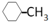
⑥CH3(CH2)5CH3→ +H2,成环,不属于取代反应、消去反应,故选,
+H2,成环,不属于取代反应、消去反应,故选,
故选:⑤⑥;
(3)①CH2=C(C2H5)(CH2)2CH(CH3)C(CH3)3的名称为:5,6,6-三甲基-2-乙基=1-庚烯,
故答案为:5,6,6-三甲基-2-乙基=1-庚烯;
②CH3CH2CH2OH的名称为:1-丙醇,故答案为:1-丙醇;
(4)由结构可知,两个相同的环在顶点位置提供CH2连接,环上C原子连接1个H原子,n个环有个顶点,故分子中C原子数目为3n,H原子数目为2n+2n=4n,故组成通式为C3nH4n(n≥3),最简式为C3H4,二十八星烷中碳的百分含量为$\frac{12×3}{12×3+1×4}$×100%=90%,
故答案为:C3nH4n(n≥3);90%.
点评 本题属于拼合型题目,涉及有机反应类型、有机物命名、有机物组成确定、基本操作等,侧重对基础知识的巩固与学生分析推理能力考查,难度中等.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 都是常用调味品的主要成分 | B. | 都能使紫色石蕊溶液褪色 | ||
| C. | 都能和CaCO3反应 | D. | 都能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
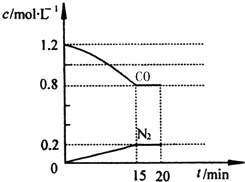
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,阴极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 在镀件上电镀铜时可用镀件作阳极,电极反应式为:Cu2++2e-═Cu | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 钢铁发生吸氧腐蚀时,正极反应式为:O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
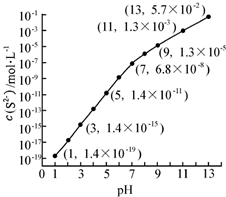 (1)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
(1)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
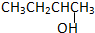 ②CH3CH2CH2CH2OH③
②CH3CH2CH2CH2OH③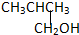 ④
④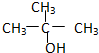
| A. | ①② | B. | 只有② | C. | ②和③ | D. | ③和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红褐色溶液物质是Fe(OH)3胶体,气泡的成分是H2 | |
| B. | 红褐色沉淀是Fe(OH)3沉淀,黑色的物质是Fe | |
| C. | 除去红褐色溶液中少量沉淀的实验方法是参析 | |
| D. | 由于Fe3+在溶液中被水分子包围形成[Fe(H2O)4]3+,不利于铝粉与Fe3+的接触反应,所以只生成少量的单质铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com