
| 金刚石 | 晶体硅 | 晶体硼 | |
| 熔点(K) | >3823 | 1683 | 2573 |
| 沸点(K) | 5100 | 2628 | 2823 |
| 硬度(Moh) | 10 | 7.0 | 9.5 |
分析 (1)一般来说,活泼金属和活泼非金属元素之间存在离子键、非金属元素之间存在共价键,分子晶体和原子晶体中存在共价键、离子晶体中存在离子键,分子晶体熔化时破坏分子间作用力、原子晶体熔化时破坏共价键、离子晶体熔化时破坏离子键,以此解答该题;
(2)①根据表中数据可以看出单质晶体硼的熔、沸点、硬度都介于典型的原子晶体,金刚石和晶体硅之间,以此判断;
②原子晶体共价键键长越长熔沸点越低.
解答 解:(1)①NaOH是离子晶体,微粒间的作用力是离子键,熔化时破坏离子键;
②干冰属于分子晶体,干冰气化,克服的是分子间作用力;
③SiO2属于原子晶体,SiO2熔化时破坏共价键;
④钠熔化克服金属键,
故答案为:①B ②D ③A ④C;
(2)①非金属单质的晶体类型主要有2种:原子晶体和分子晶体,由于作用力强弱相差悬殊,物理性质(熔、沸点、硬度)差别也甚大,因此根据表中数据可以看出单质晶体硼的熔、沸点、硬度都介于典型的原子晶体,金刚石和晶体硅之间,因此晶体硼当属原子晶体;
故答案为:原子;
②C-C键长比Si-Si键长短,所以C-C键能比Si-Si键能大,熔化或汽化所需要的能量多,所以金刚石的熔、沸点比晶体硅高,所以金刚石的熔沸点高于晶体硅,
故答案为:C-C键长比Si-Si键长短,所以C-C键能比Si-Si键能大,熔化或汽化所需要的能量多,所以金刚石的熔、沸点比晶体硅高.
点评 本题考查了微粒之间的作用力,此类题的解题方法是:先判断晶体类型,再判断克服的作用力,题目比较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学只研究自然界中存在的物质 | |
| B. | 化学的特征是认识分子和制造分子 | |
| C. | 通过化学方法可以制造出使人长生不老的“仙丹” | |
| D. | 化学的研究层面越来越广,原子核的变化也已成为化学研究的范畴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液与盐酸反应生成氯化银 | |
| B. | 镁条与氯化铵溶液反应生成氢气 | |
| C. | 盐酸与碳酸钙反生成二氧化碳 | |
| D. | 硫酸铝溶液和小苏打溶液反应生成二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用.
盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH3)CH(C2H5)CH3的系统命名法的名称为2-甲基-3-乙基丁烷 | |
| B. | 乙炔的结构简式为CHCH,乙烯的球棍模型为 | |
| C. | 己烯和苯都是不饱和烃,都能使酸性高锰酸钾溶液褪色 | |
| D. | 向溴乙烷中直接滴加硝酸银溶液,看不到淡黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配位体是Cl-和H2O,配位数是9 | |
| B. | 中心离子是Ti3+,形成配位键时提供电子对 | |
| C. | 配离子是[TiCl(H2O)5]2+,内界和外界中的Cl-的数目比是1:2 | |
| D. | 向含1 mol该配合物的水溶液中加入足量AgNO3溶液,生成AgCl沉淀3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
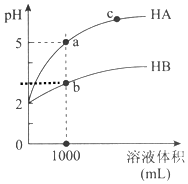 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示:
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示:| 物质 | 稀释中变化 | 稀释中n(H+)变化 | 稀释中c(H+)减小程度 |
| HA | HA=H++A-不移动 | 不变 | 大 |
| HB | HB?H++B- 正向移动 | 增加 | 小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
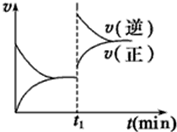 如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )
如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )| A. | 2SO2(g)+O2(g)?2SO3(g);△H<0 | B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H<0 | ||
| C. | H2(g)+I2(g)?2HI(g);△H>0 | D. | N2(g)+3H2(g)?2 NH3(g)△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com