
【题目】利用“化学计量在实验中的应用”的相关知识进行填空(设 NA 表示阿伏加德罗常 数的值)。
(1)标准状况下,0.2 mol 氨气的体积是_______________,含氢原子数是_______________。
(2)H2SO4 的摩尔质量是_______________, 49 g 的 H2SO4 中含有_______________mol 氧原子,能与_______________mol NaOH 恰好完 全反应。
(3)将 0.5 mol Na2CO3溶解在水中,配成 500mL 溶液,所得溶液中溶质的物质的量浓度是 ______________。
【答案】4.48L 0.6NA 98g/mol 2 1 1molL-1
【解析】
(1)标准状况下,气体摩尔体积为22.4L/mol,根据V=nVm计算0.2mol氨气的体积;先计算0.2molNH3的分子数,一个氨气分子中含有3个氢原子,进而计算所含氢原子数是;
(2)摩尔质量在数值上与其相对分子质量相等,先计算49g的H2SO4物质的量,再结合分子组成,计算含有氧原子物质的量;H2SO4是二元强酸,0.5mol H2SO4能电离产生1mol氢离子,据此计算需要氢氧化钠的物质的量;
(3)根据![]() 计算碳酸钠溶液的浓度。
计算碳酸钠溶液的浓度。
(1)标准状况下,气体摩尔体积为22.4L/mol,0.2mol氨气的体积是0.2mol×22.4L/mol= 4.48L,其中含有的NH3分子数是0.2mol×NA=0.2NA,一个氨气分子中含有3个氢原子,则含氢原子数是0.2NA×3=0.6NA;
故答案为:4.48L;0.6NA;
(2)H2SO4的摩尔质量是98g/mol,49g的H2SO4物质的量为![]() ,含有氧原子物质的量为0.5mol×4=2mol;H2SO4是二元强酸,0.5mol H2SO4能电离产生1mol氢离子,则其可与1molNaOH恰好完全反应;
,含有氧原子物质的量为0.5mol×4=2mol;H2SO4是二元强酸,0.5mol H2SO4能电离产生1mol氢离子,则其可与1molNaOH恰好完全反应;
故答案为:98g/mol;2;1;
(3)将0.5molNa2CO3溶解在水中,配成500mL溶液,所得溶液中溶质的物质的量浓度是![]() ;
;
故答案为:1molL-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka= 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7Ka2=5.6×l0-11 |
①0.1moI/LNaCN溶液和0.1mol/LNaHCO3溶液中,c(CN-)___c(HCO3-)(填“>”、“<”或“=”)。
②常温下,物质的量浓度相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其pH由大到小的顺序是___(填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____。
④室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____,溶液中c(CH3COO-)/c(CH3COOH)=____。
(2)某温度下,pH=3的盐酸中[OH-]=10-9mol/L。该温度下, pH=2的H2SO4与pH=11的NaOH混合后pH变为9,则硫酸与氢氧化钠的体积比为____。
(3)室温下,用0.100mol/L盐酸溶液滴定20.00mL0.l00mol/L的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。

①d点所示的溶液中离子浓度由大到小的顺序依次为______。
②b点所示的溶液中c(NH4+)-c(NH3·H2O)=_____(写出准确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于某些离子的检验说法中正确的是
A.向某溶液中加稀盐酸,能产生澄清石灰水变浑浊的无色、无味的气体,则该溶液中一定有CO32-
B.向某溶液中加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,则该溶液中一定有SO42-
C.向某溶液中加入浓NaOH溶液并加热,能产生使湿润的红色石蕊试纸变蓝的气体,则该溶液一定有NH4+
D.向某溶液中加入AgNO3溶液产生白色沉淀,则该溶液中一定含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为___________。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3 、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
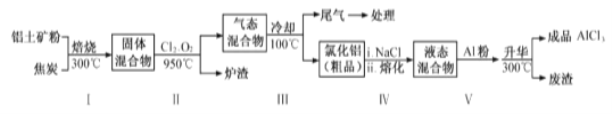
已知:

①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是_____(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是_____。
③步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为_________________________。
④结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
![]()
![]()
![]()
![]()
![]()
试回答:
(1)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)________________,检验此C溶液中金属元素价态的操作方法是__________。
(2)若A、B、C为含有金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为________,X的化学式可能为(写出不同类物质)________或________,反应①的离子方程式为____________或_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的是
A. 磁性氧化铁溶于氢碘酸:Fe3O4+8H+=2Fe3++Fe2++4H2O
B. FeBr2中通入氯气使一半的Br氧化:2Fe2++2Br+ 2Cl2=2Fe3++Br2+4Cl
C. NH4Al(SO4)2溶液中加入过量的Ba(OH)2:NH4++Al3++2SO42-+2Ba2++4OH=NH3·H2O+AlO2-+2BaSO4↓+H2O
D. 饱和FeCl3溶液滴入沸水制氢氧化铁胶体:Fe3++3H2O(沸水)![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质互为同分异构体的是( )
A. CH3—CH3和CH3—CH2—CH3
B. 12C和14C
C. CH3—CH2—CH2—CH3和(CH3)2CHCH3
D. 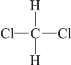 和
和 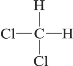
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
[Zn(CN)4]2–在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2–+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN
(1)Zn2+基态核外电子排布式为____________________。
(2)1 mol HCHO分子中含有σ键的数目为____________mol。
(3)HOCH2CN分子中碳原子轨道的杂化类型是______________。
(4)与H2O分子互为等电子体的阴离子为________________。
(5)[Zn(CN)4]2–中Zn2+与CN–的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2–的结构可用示意图表示为_____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com