
下列实验方案不可行或结论不正确的是
① 用酸性高锰酸钾溶液除去乙烷气体中的少量乙烯
② 将溴乙烷和NaOH溶液混合加热后,再加入硝酸银溶液,检验溴元素
③ 分液时,分液漏斗里下层液体从下口放出,上层液体从上口倒出
④ 向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉至完全反应,通过比较产生H2的体积判断两种酸的电离程度:醋酸<盐酸
⑤ 向新制的AgCl乳白色悬浊液中滴加0.1 mol/L的KI溶液,产生黄色沉淀,证明:Ksp[AgCl]>Ksp[AgI]
| A.①② | B.①③⑤ | C.②④ | D.③④⑤ |
A
解析试题分析:①、酸性高锰酸钾溶液能把乙烯氧化生成CO2,因此不能用酸性高锰酸钾溶液除去乙烷气体中的少量乙烯,应该用溴水,①不正确;
②、将溴乙烷和NaOH溶液混合加热后,应该先加入硝酸酸化后,再加入硝酸银溶液,检验溴元素,②不正确;
③、分液时,分液漏斗里下层液体从下口放出,上层液体从上口倒出,③正确;
④、醋酸是弱酸,存在电离平衡,因此在pH相同的条件下,醋酸的浓度大于盐酸的浓度。则向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉至完全反应,醋酸产生的气体体积多,所以通过比较产生H2的体积判断可以两种酸的电离程度是醋酸<盐酸,④正确;
⑤、由于沉淀容易向生成更难溶的方向进行,所以向新制的AgCl乳白色悬浊液中滴加0.1 mol/L的KI溶液,如果产生黄色沉淀,则可以证明:Ksp[AgCl]>Ksp[AgI],⑤正确,答案选A。
考点:考查化学实验基本操作、实验方案设计与评价等


科目:高中化学 来源: 题型:单选题
下列实验方案不能达到实验目的的是:
| | 实验目的 | 实验方案 |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入足量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D | 探究温度对化学平衡的影响 | 将NO2球浸泡在冷、热水中,观察颜色的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验操作、现象与结论对应关系正确的是
| 选项 | 实验操作 | 实验现象与结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol·L-1 H2SO4溶液 | 试管口出现红棕色气体。则溶液中NO3-被Fe2+还原为NO2 |
| B | 向样品溶液中先滴加过量的稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀。说明样品溶液中一定含有SO42- |
| C | 向0.1mol·L-1 Na2CO3溶液中,滴加2滴酚酞显浅红色,微热 | 红色加深。说明盐类水解是吸热反应 |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成。表明淀粉没有水解生成葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验方法和解释或结论都正确的是
| | 实验目的 | 实验方法 | 解释或结论 |
| A | 检验CH2=CH-CHO中含碳碳双键 | 将丙烯醛溶液滴入溴水中,溴水褪色 | 丙烯醛中碳碳双键与溴单质发生了加成反应 |
| B | 确认某无机酸浓溶液的溶质 | 用蘸有浓氨水的玻璃棒放于试剂瓶口,有大量白烟 | 该无机酸一定为盐酸 |
| C | 鉴别一份红棕色气体成分 | 湿润的淀粉碘化钾试纸插入气体中,试纸变蓝 | 该气体一定为Br2 |
| D | 探究高级脂肪酸甘油酯水解的条件 | 高级脂肪酸甘油酯中加入NaOH溶液加热后不再分层 | 高级脂肪酸甘油酯发生皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验“操作和现象”与“结论”对应关系正确的是
| | 操作和现象 | 结论 |
| A | 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 | Ksp:CaCO3<CaSO4 |
| B | 用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成 | 该电极为阳极 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 氧化性:Cu2+>Fe3+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上由废铜屑制硫酸铜晶体的流程如下:
(1)下列溶解铜屑的两种方案中,方案二的优点是 。(答两点即可)
方案一:向铜屑中加入足量的浓硫酸并加热。
方案二:向铜屑中加入少量的银粉再加足量的稀硫酸并通入足量空气。
(2)测定硫酸铜晶体( CuSO4·xH2O)中结晶水数目可通过以下实验步骤确定:
Ⅰ.称取0.4820 g样品置于小烧杯中,加入适量稀硫酸,加热溶解,边搅拌边滴加BaCl2到沉淀完全;
Ⅱ.过滤并洗涤沉淀;
Ⅲ.将盛有沉淀的滤纸包烘干并高温灼烧,再转入高温炉中,一定温度下反复灼烧到恒重,得到BaSO4质量为0.4660 g。
回答下列问题:
①计算CuSO4·xH2O中的x= (要求写出计算过程)。
②步骤Ⅲ中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,若其他操作均正确,则x的测定结果将 (填“偏低”、“偏高”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)乙醚极易挥发、微溶于水、是良好的有机溶剂。乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚。某实验小组用下图装置制取乙醚和乙烯。
1.制乙醚:在蒸馏烧瓶中先加入10 mL乙醇,慢慢加入10 mL浓硫酸,冷却,固定装置。加热到140℃时,打开分液漏斗活塞,继续滴加10 mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体。
(1)Ⅰ和Ⅱ是反应发生装置,应该选择 (选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连。
(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是
。
2.Ⅲ中水冷凝管的进水口是 (选答“a”或“b”)。冰盐水的作用是 。
3.有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险。该同学设
计了以下几种装置与导管d连接,你认为合理的是(选填编号) 。
4.反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色。写出实验过程中有气体生成化学方程式(写两个方程式) ; 。
5.实验中收集到的乙醚产品中可能含有多种杂质。某同学设计了以下提纯方案:
(1)分液步骤除去产品中的酸性杂质,则X可以是 。
(2)蒸馏操作可除去的杂质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列①~④四个图是某学习小组设计的相关物质的制备装置,其中正确的是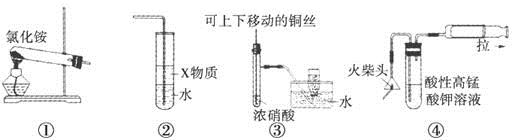
| A.用装置①可以制备氨气 |
| B.若装置②中X物质为苯,可用于实验室制备少量氨水,并防止发生倒吸 |
| C.装置③可用于制备并收集少量NO2气体 |
| D.装置④可用火柴头燃烧制备少量SO2,并检验产生的SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验方案不能达到实验目的的是( )
| | 实验目的 | 实验方案 |
| A | 探究接触面积对化学反应速率的影响 | 相同温度下,取等质量的大理石块、大理石粉分别投入等体积、等浓度的盐酸中 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2 mL 1 mol·L-1 NaOH溶液中先加入3滴1 mol·L-1 MgCl2溶液,再加入3滴1 mol·L-1 FeCl3溶液 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入适量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D | 测定铝箔中氧化铝的含量 | 取a g铝箔与足量稀盐酸充分反应,逸出的气体通过碱石灰后,测其体积为b L(已转化为标准状况下) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com