
【题目】物质的量是沟通宏观和微观的桥梁,请回答下列问题。
(1)同温同压下的两个相同容器中分别装有NO和NO2气体,则两瓶气体中,原子数之比是___,质量之比是___,密度之比是___分子数之比是___.
(2)下列所给出的几组物质中:含有分子数最少的是___;含有原子数最多的是___;标准状况下体积最小的是___.
①1gH2; ②2.408×1023个CH4; ③10.8gH2O; ④标准状况下6.72LCO2.
(3)设NA表示阿伏伽德罗常数,如果x g某气体含有的分子数是y,则z g该气体在标准状况下的体积是 _________________L(用含NA的式子表示)
【答案】 2:3 15:23 15:23 1:1 ④ ② ③ ![]()
【解析】(1)同温同压下的两个相同容器中分别装有NO和NO2气体,由于同温同压下气体的气体摩尔体积相等,由n=![]() 可知,气体的分子数相等,比值为1:1,则原子数为2:3,质量比等于摩尔质量之比,为15:23,密度之比等于摩尔质量之比等于15:23,故答案为:2:3;15:23;15:23;1:1;
可知,气体的分子数相等,比值为1:1,则原子数为2:3,质量比等于摩尔质量之比,为15:23,密度之比等于摩尔质量之比等于15:23,故答案为:2:3;15:23;15:23;1:1;
(2)①n(H2)= ![]() =0.5mol,V(H2)=0.5mol×22.4L/mol=11.2L,含有原子的物质的量为1mol;②n(CH4)=
=0.5mol,V(H2)=0.5mol×22.4L/mol=11.2L,含有原子的物质的量为1mol;②n(CH4)= ![]() =0.4mol,V(CH4)=0.4mol×22.4L/mol=8.96L,原子的物质的量为2mol;③n(H2O)=
=0.4mol,V(CH4)=0.4mol×22.4L/mol=8.96L,原子的物质的量为2mol;③n(H2O)= ![]() =0.6mol,原子的物质的量为1.8mol,体积约为10.8mL;④n(CO2)=
=0.6mol,原子的物质的量为1.8mol,体积约为10.8mL;④n(CO2)= ![]() =0.3mol,原子的物质的量为0.9mol,物质的量越小,分子数越少,含有分子数最少的是④;原子的物质的量越多,原子个数越多,最多的为②;标准状况下体积最小的是③,故答案为:④;②;③;
=0.3mol,原子的物质的量为0.9mol,物质的量越小,分子数越少,含有分子数最少的是④;原子的物质的量越多,原子个数越多,最多的为②;标准状况下体积最小的是③,故答案为:④;②;③;
(3)a克某气体中含有的分子数为y,则z克气体含有的分子数为![]() ,z克该气体的物质的量为
,z克该气体的物质的量为![]() =
=![]() mol,在标准状况下Vm=22.4L/mol,则zg该气体的体积为
mol,在标准状况下Vm=22.4L/mol,则zg该气体的体积为![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L;故答案为:
L;故答案为: ![]() 。
。


科目:高中化学 来源: 题型:
【题目】NA是阿伏伽德罗常数,据报道,科学家已成功合成了少量N4 , 有关N4的说法正确的是( )
A.N4和N2是互为同位素
B.1molN4分子含有28NA个电子
C.相同质量的N4和N2所含原子个数比为2:1
D.N4的摩尔质量是56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出以下反应的化学方程式:
(1)Na2O2与CO2反应:_______________
(2)加热使NaHCO3分解:____________
(3)Al与NaOH溶液反应:______________
(4)Fe(OH)2长时间露置于空气中:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下关于氧化还原反应的说法正确的是( )
A. 还原剂中必定有元素被氧化
B. 在氧化还原反应中,失去电子的元素化合价降低
C. 物质中某元素失去电子,则此物质是氧化剂
D. 物质所含元素化合价升高的反应叫还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的化学式:
(1)重晶石___________________
(2)胆矾_____________________
(3)熟石膏____________________
(4)明矾_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,Ni2+与丁二酮肟生成鲜红色沉淀A. 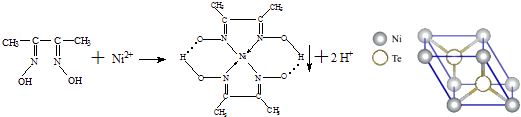
(1)基态Ni2+的核外电子排布式为 .
(2)丁二酮肟组成元素中C,N,O的电负性由大到小的顺序为 .
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为 .
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为﹣19.3℃.Ni(CO)4的晶体类型是 .
(5)人们在研究分子结构时发现,CO与N2分子结构非常相似,我们把具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这一原理称为“等电子体”.请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式 .
(6)对于A物质: ①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是 , 氮镍之间形成的化学键是;
②该结构中,氧氢之间除共价键外还可存在 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】24mL浓度为0.05mol·L-1Na2SO3溶液恰好与20mL 浓度为0.02mol·L-1的K2X2O7溶液完全反应,已知Na2SO3可被K2X2O7氧化为Na2SO4,则元素X在还原产物中的化合价为下列的
A. +2 价 B. +3 价 C. +4价 D. +5价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 氢氧化钡溶液和稀硫酸反应:Ba2+ + SO![]() =BaSO4↓
=BaSO4↓
B. 铁与稀硫酸反应: 2Fe + 6H+ =2Fe3+ + 3H2↑
C. 稀醋酸加入到氢氧化钡溶液中:H+ + OH-=H2O
D. 氯化铝溶液中加入过量氨水:Al3+ + 3NH3·H2O=Al(OH)3↓+ 3 NH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)具有耐高温、抗冲击导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C![]() 2AlN+3CO,下列叙述正确的是
2AlN+3CO,下列叙述正确的是
A. 在氮化铝合成反应中,N2是还原剂,Al2O3是氧化剂
B. 氮化铝晶体熔沸点很低
C. 氮化铝中氮元素化合价为-3价
D. 上述反应中每生成2molAlN,N2得到3mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com