
| A. | 实验室制取氯气 MnO2+4HCl(浓)═Mn2++2 Cl-+Cl2+2H2O | |
| B. | 少量的氢氧化钠溶液滴加到足量氯化铝溶液 Al3++4OH-═AlO2-+2H2O | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 硅酸钠溶液中滴加盐酸:SiO32-+2H+═H2SiO3↓ |
分析 A.浓盐酸中氯化氢应拆成离子形式;
B.不符合反应客观事实;
C.电荷不守恒;
D.硅酸钠溶液中滴加盐酸生成硅酸和氯化钠.
解答 解:A.实验室制取氯气,离子方程式:MnO2+4H++2Cl-═Mn2++Cl2+2H2O,故A错误;
B.少量的氢氧化钠溶液滴加到足量氯化铝溶液,反应生成氢氧化铝,离子方程式:Al3++3OH-═Al(OH)3↓,故B错误;
C.利用腐蚀法制作印刷线路板,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故C错误;
D.硅酸钠溶液中滴加盐酸,离子方程式:SiO32-+2H+═H2SiO3↓,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
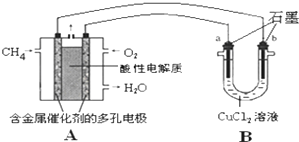
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑦ | B. | 全部 | C. | ③④⑤⑦⑧ | D. | ①②⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
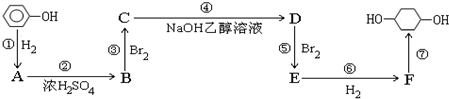
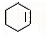 ; F
; F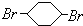 ;
;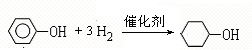 ;
;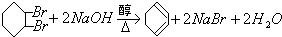 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入适量的6mol/L的盐酸 | B. | 加入数滴氯化铜溶液 | ||
| C. | 加入适量醋酸钠溶液 | D. | 加入适量的NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com