
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源:2013-2014学年内蒙古鄂尔多斯市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
298 K时,某容积固定为1 L的密闭容器中发生如下可逆反应:A(g) 2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
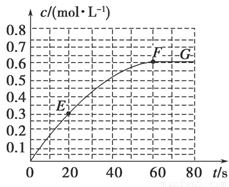
试回答下列问题。
(1)已知298 K时60 s达到平衡,比较40~60 s内和60~80s内B的平均反应速率:v(40~60) v(60~80)(填“﹥”或“﹦”或“﹤”)。
(2)若298 K达到平衡时,B的平衡浓度为A的3倍,共放出热量x kJ,开始加入A的物质的量是 mol。
(3)298k时,该反应的平衡常数为 mol/L。
(4)若反应在298 K进行,在1 L密闭容器中加入1 mol B、0.2 mol Ne,达到平衡时共吸收热量y kJ,此时B的转化率为 (填序号)。
A.等于60% B.等于40%
C.小于40% D.介于40%~60%之间
(5)结合(2)、(4)相关数据,写出a、x、y三者的等式关系式: 。
(6)若反应在298K进行,反应起始浓度为c(A)=c(B)=1.0mol/L,则化学平衡将 (填“正向”“逆向”或“不”)移动。
(7)已知曲线上任意两点之间连线的斜率表示该时间段内B的平均反应速率(例如直线EF的斜率表示20 s~60 s内B的平均反应速率),则曲线上任意一点的切线斜率的意义是 。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:计算题
查看答案和解析>>
科目:高中化学 来源:同步题 题型:计算题
在298K时,下列反应的ΔH依次为:
C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l) ΔH1=-1366.8kJ·mol-1
C(石墨)+O2(g)→CO2(g) ΔH2=-393.5kJ·mol-1
H2(g)+1/2O2(g)→H2O(l) ΔH3=-285.8kJ·mol-1
乙醇(C2H5OH)、氢气、石墨和氧气的熵值分别为:161.0、130.6、5.74、205.3(J·mol-1·K-1),则298K时,由单质生成1 mol乙醇的ΔH、ΔS及ΔH-TΔS分别为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
在298K下,下列反应的D![]() H
H![]() 依次为:
依次为:
C8H18(g) + 25/2O2(g) → 8CO2(g) + 9H2O(l) D1H![]() = 5512.4 kJ?mol-1
= 5512.4 kJ?mol-1
C(石墨) + O2(g) → CO2(g) D2H![]() = 393.5 kJ?mol-1
= 393.5 kJ?mol-1
H2(g) + 1/2O2(g) → H2O(l) D3H![]() = 285.8 kJ?mol-1
= 285.8 kJ?mol-1
正辛烷、氢气和石墨的标准熵分别为:463.7,130.6,5.694J?K-1?mol-1。
设正辛烷和氢气为理想气体,问:
(1)298K下,由单质生成1mol正辛烷的反应的平衡常数![]() ,给出计算过程。
,给出计算过程。
(2)增加压力对提高正辛烷的产率是否有利?为什么?
(3)升高温度对提高产率是否有利?为什么?
(4)若在298 K及101.325 kPa下进行,平衡混合物中正辛烷的摩尔分数能否达到0.1?
(5)若希望正辛烷在平衡混合物中的摩尔分数达到0.5,则在298K时,需要多大的压力才行?给出计算过程。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com