
元素周期律:元素的性质随着____________的递增而呈__________的规律称元素周期律.注:这里所说的元素性质,中学阶段主要是指元素原子的_________、_________和_________等方面.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| 一定条件 |


| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 341 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:


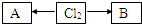 ,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013届吉林省高二下学期期中考试化学试卷(解析版) 题型:填空题
(15分)下表是元素周期律的一部分。根据表中的10种元素,用元素符号或化学式填空。
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
① |
|
② |
③ |
|
|
3 |
⑧ |
|
⑨ |
④ |
|
⑤ |
⑥ |
⑦ |
|
4 |
|
|
|
|
|
|
⑩ |
|
(1)在 ①~⑩ 元素中金属性最强的金属元素是 ;第一电离能最小的元素是 ;电负性最强的元素是
(2)在 ①~⑩ 元素的最高价氧化物的水化物呈两性的是 ;⑥形成的最高价氧化物的水化物的分子式是 ;
(3)①形成的气态氢化物的结构式是 ;其中心原子采取 杂化,空间构型为
(4)①和②形成的化合物是 晶体,电子式是 ;①和④、②和④可形成 (填“离子”或“共价”)化合物,是 晶体,熔点高的是 ,理由 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省莱芜市高一(下)期末化学试卷(解析版) 题型:解答题
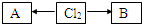 ,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式______ MnCl2+Cl2↑+2H2O
,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式______ MnCl2+Cl2↑+2H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com