
Na2CO3+2HCl══2NaCl+H2O+CO2↑
会使滴定结果产生误差的是( )
A.称量无水碳酸钠时,所用砝码沾有脏物未抹去
B.准确移取盐酸至锥形瓶后,又加入少量蒸馏水
C.标准溶液露置时曾吸收空气中的二氧化碳,但溶液的体积未变
D.以酚酞作指示剂
| 解题思路:本题碳酸钠溶液是标准溶液,盐酸是待测液。
NazCO3+2HCl══2NaCl+H2O+CO2↑ 计算式是 (1)称量无水碳酸钠时,砝码沾有脏物,称得的无水碳酸钠质量大于实际的质量,配制的Na2CO3溶液浓度偏高,通过滴定消耗Na2cO3溶液的体积偏小,这样计算出的c(HCl)偏低。 (2)在盛有盐酸的锥形瓶中,加入少量蒸馏水,尽管盐酸变稀,但盐酸物质的量不变,消耗Na2CO3的体积也不变,所以对测定c(HCl)无影响。 (3)碳酸钠溶液吸收二氧化碳,发生如下反应: Na2CO3+CO2+H2O══2NaHCO3 1molNa2CO3倘若与CO2完全反应,生成2molNaHCO3,与盐酸反应时,消耗2molHCl。 1molNa2CO3倘若未吸收CO2,与盐酸反应时,也消耗2molHCl。 所以标准溶液吸收二氧化碳,对测定c(HCl)无影响。 (4)当以酚酞作指示剂时,pH达8时为滴定终点,此时溶液已呈弱碱性,但由于本实验是以Na2CO3去滴HCl(aq),反应始终按生成CO2的方式进行,故pH=8时,Na2CO3过量少许,但误差仍在允许范围内。若是改为盐酸滴碳酸钠时,则不能用酚酞作指示剂,应选用甲基橙。
|


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:阅读理解
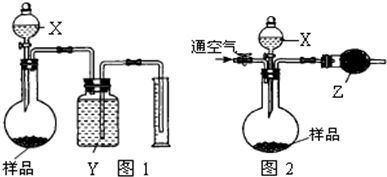
| ||
| m |
| ||
| m |
查看答案和解析>>
科目:高中化学 来源: 题型:013
用无水碳酸钠配成标准溶液,滴定未知浓度的盐酸时反应方程式如下:
Na2CO3+2HCl══2NaCl+H2O+CO2↑
会使滴定结果产生误差的是( )
A.称量无水碳酸钠时,所用砝码沾有脏物未抹去
B.准确移取盐酸至锥形瓶后,又加入少量蒸馏水
C.标准溶液露置时曾吸收空气中的二氧化碳,但溶液的体积未变
D.以酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:实验题
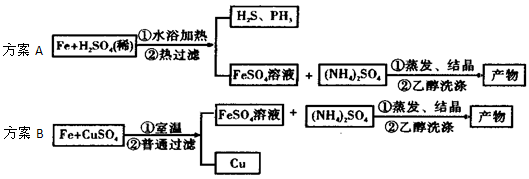


查看答案和解析>>
科目:高中化学 来源: 题型:
已知基准物是某些纯度高、稳定性好的物质.可在准确称量其质量后直接配成标准溶液并标定溶液浓度.现有用浓盐酸新配制出的标准溶液,由于 (填写原因)使得浓度不很精确.该盐酸在使用前,需用基准物进行标定.实验室标定标准的盐酸一般选用纯净的无水碳酸钠作基准物.
①上述基准物能否改用纯净的氢氧化钠固体 (“能”或“不能”);简述理由
②某学生误将一种不纯的碳酸钠样品作基准物,则所测得的盐酸浓度将 (填偏高、偏低、无法确定、不受影响).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com