
| A、加适量的醋酸钠晶体后,两溶液的pH均增大 |
| B、温度都升高20℃后,两溶液的pH均不变 |
| C、加水稀释两倍后,两溶液的pH均减小 |
| D、加足量的锌充分反应后,两溶液中产生的氢气一样多 |


科目:高中化学 来源: 题型:
| A、x的取值范围是0<x≤0.25 | ||
| B、无论x为何值,当加入87.5 mL的KOH时,溶液中的阳离子恰好完全沉淀 | ||
| C、当100 mL KOH刚好完全消耗,且Al3+全部转化为AlO2-时,x的值为0.2 | ||
D、若反应前Al3+的物质的量为a mol,则a=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该温度下,0.31 mol?L-1 HF溶液的pH=2 |
| B、升高温度或增大浓度,HF的电离平衡常数都将增大 |
| C、两溶液混合后不会产生沉淀 |
| D、向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.117 |
| B、0.351g |
| C、0.585g |
| D、0.234g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| A、将2.4 g碳完全转化为水煤气,然后再燃烧,整个过程△H=-78.7 kJ/mol?? |
| B、H的燃烧热为241.8 kJ/mol?? |
| C、由反应②可推知,CO具有还原性而没有氧化性 |
| D、由反应③可知,反应过程中转移5 mol电子且生成液态水时放出的热量小于604.5 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78g苯中含有碳碳双键3NA个 |
| B、1mol甲基(-CH3)含有电子数为10NA个 |
| C、14 g乙烯和丙烯的混合物中总原子数为3NA个 |
| D、在标准状况下,11.2L辛烷中的碳原子数为4 NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
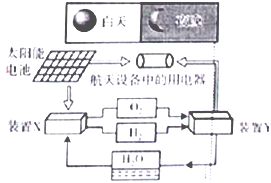 如图是一种航天器能量储存系统原理示意图.下列说法正确的是
如图是一种航天器能量储存系统原理示意图.下列说法正确的是| A、该系统中只存在3种形式的能量转化 |
| B、装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- |
| C、装置X能实现燃料电池的燃料和氧化剂再生 |
| D、该系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 100℃ | 300℃ | 500℃ |
| K | 0.125 | 0.95 | 3.2 |
| c(CO2)?[c(N2)]2 |
| c(N2O)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向FeI溶液中不断通入Cl2,溶液中I-、Cl-、I
向FeI溶液中不断通入Cl2,溶液中I-、Cl-、I| O | - 3 |
| O | - 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com