
(5分)已知化学反应N2+3H2=2NH3的能量变化如图所示,

(1)1mol N 和3mol H 生成1mol NH3(g)是 能量的过程(填“吸收”或“释放”)。
(2) N2(g)+
N2(g)+ H2(g)=NH3(g);
H2(g)=NH3(g);
△H= ;
(3)N2(g)和H2生成NH3(1)的热化学方程式为
科目:高中化学 来源:2012届河北省石家庄市高三第二次模拟理科综合化学试卷(带解析) 题型:填空题
[化学一选修2:化学与技术](15分)已知:
①工业上用硫酸与 -锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
-锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
②氢氧化锂在一定温度下可转化为氧化锂。用 -锂辉矿与硫酸等物质制备金属锂的工业流程如下图:
-锂辉矿与硫酸等物质制备金属锂的工业流程如下图: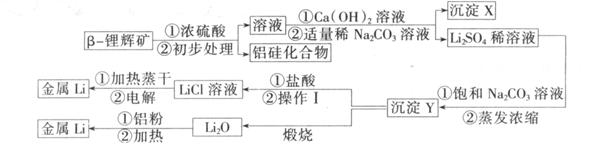
请回答:
(1)沉淀Y的主要成分的化学式是____________。
(2)流程中使用了不同浓度的Na2CO3溶液,从物质溶解度大小的角度解释其使用的原因____________
(3 )操作1涉及的实验方法是__________________。
(4 )写出用铝粉还原法制取金属锂的化学反应方程式。________________________
(5) LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂。电解时产生的氯气中混有少量氧气,产生氧气的原因是__________________
(6) 目前电池通常使用金属锂的优点是__________________
查看答案和解析>>
科目:高中化学 来源:2010-2011学年宁夏高三第三次月考(理科综合)化学卷 题型:填空题
某化学课外小组模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。请回答下列问题:

(1)写出装置A中主要反应的化学方程式 (2分)
(2)如何检查装置A的气密性 (2分)
(3)已知1molNO2与液态水反应生成HNO3溶液和NO气体放出热量45.5kJ,写出该反应的热化学方程式 (2分)
该反应是一个可逆反应,欲要提高NO2的转化率,可采取的措施是________(2分)
A.升高温度 B.降低温度 C.增大压强 D.增大压强
(4)实验结束后,关闭止水夹b、c,将装置D,浸入冰水中,现象是______(2分)
(5)装置C中浓H2SO4的作用是 (2分)
(6)请你帮助该化学小组设计实验室制取NH3的另一方案 (用化学反应方程式表示)(2分)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年宁夏高三上学期期末考试(理综)化学部分 题型:填空题
(15分)《物质结构与性质》(每空2分,化学反应方程式3分)
Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、4、6,且都含有18个电子,其中B、C是由两种元素的原子组成,且B分子中两种元素原子的个数比均为1 :2 ,C分子中两种元素原子的个数比均为1 :1,D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是 ;
(2)从B分子的立体结构判断,该分子属于 分子(填“极性”或“非极性”);分子空间结构为_______型。
(3)C在实验室可用来制取常见的一种气体单质,试写出该化学反应方程式
________________________________________________________________________。
(4)D的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明D是何物质):
________________________________________________________________________。
Ⅱ. Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(5)基态Cu原子的核外电子排布式为 。
(6)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。
查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二上学期期中考试化学试卷 题型:填空题
(12分)煤的综合利用是当代化学工业的趋势,以煤为原料可合成重要化工中间体G。其中B与乙酸互为同分异构体,能与Na反应放出氢气。
已知:① CH3CHO + CH3CHO


回答下列问题:
(1)煤的干馏属于____________变化,实验室检验D所用的试剂为________________________。
(2)A和F的结构简式分别为_____________________、______________________________。
(3)写出B→C的化学方程式___________________________________________________。
H→I的化学方程式___________________________________________________。
(4)能与Na2CO3溶液反应的E的芳香族化合物的同分异构体有________________种。
(5)根据已知信息,在一定条件下由G合成  至少需要_______步化学反应。
至少需要_______步化学反应。
a.3 b.4 c.5 d.6
查看答案和解析>>
科目:高中化学 来源:2014届成都铁中高一3月检测化学试卷 题型:实验题
(16分,每空2分)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
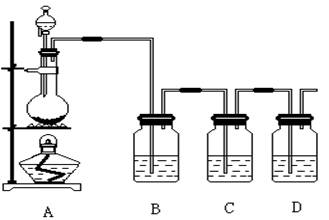
(1)装置A的分液漏斗中盛装的试剂是 ,烧瓶中的化学反应方程式 。
(2)装置B所加试剂饱和NaCl溶液,其装置的作用是 。
(3)装置C中盛放的试剂是 (选填下列所给试剂的代码),实验现象为 ,
该反应的离子方程式是 。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁;⑦硫原子与氯原子电子层数相同,氯原子半径小于硫原子。可说明氯比硫非金属性强的是
A.全部 B.②③④⑥⑦ C.①②④⑤⑥ D.除 ①以外
(5)装置D中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,写出反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com