

分析 (1)①相同压强下,升高温度平衡逆向移动,氨气含量降低;
②A.缩小容器体积相当于增大压强,平衡正向移动;
B.M点时氨的物质的量的分数为60%,利用三段式,设N2转化率是x
N2(g)+3H2(g)?2NH3(g)
起始 1 3 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
$\frac{2x}{1-x+3-3x+2x}$=60%,计算x即为氮气转化率;
C.该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小;
D.N点时氨的物质的量的分数为20%,利用三段式,设N2转化率是b,N2的起始浓度为a,
根据反应N2(g)+3H2(g)?2NH3(g)
起始 a 3a 0
转化 ab 3ab 2ab
平衡 a-ab 3a-3ab 2ab
$\left\{\begin{array}{l}{\frac{2ab}{a-ab+3a-3ab+2ab}×100%=20%}\\{2ab=0.2}\end{array}\right.$
解得$\left\{\begin{array}{l}{a=0.3}\\{b=\frac{1}{3}}\end{array}\right.$,据此计算平衡常数K;
(2)溶液呈中性,则c(H+)=c(OH-),根据电荷守恒判断离子浓度;
(3)Ⅰ.将两个方程式相加即得NH3、CO2为原料合成尿素的热化学方程式,焓变进行相应的改变;
Ⅱ.①合成尿素总反应的快慢由第二步反应决定;
②在0~10min内,第一步反应的速率v(CO2)=$\frac{\frac{1-0.26}{0.5}}{10}$ mol•L-1•min-1=0.148mol•L-1•min-1,v(NH3)=2v(CO2);
③第二步的正反应是吸热反应,升高温度平衡正向移动;
(4)该燃料电池中,通入氨气的电极是负极,通入氧气的电极是正极,负极上氨气失电子和氧离子反应生成氮气和水,正极上氧气得电子生成氧离子.
解答 解:(1)①相同压强下,升高温度平衡逆向移动,氨气含量降低,根据图知,a、b、c的温度分别是200℃、400℃、600℃,故答案为:200℃;
②A.缩小容器体积相当于增大压强,平衡正向移动,氢气转化率增大,故A正确;
B.M点时氨的物质的量的分数为60%,利用三段式,设N2转化率是x
N2(g)+3H2(g)?2NH3(g)
起始 1 3 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
$\frac{2x}{1-x+3-3x+2x}$=60%,x=75%,
故B错误;
C.该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小,M、Q温度相同其化学平衡常数相等,M温度小于N,则M化学平衡常数大于N,所以这三点化学平衡常数K(M)=K(Q)>K(N)
,故C错误;
D.N点时氨的物质的量的分数为20%,利用三段式,设N2转化率是b,N2的起始浓度为a,
根据反应N2(g)+3H2(g)?2NH3(g)
起始 a 3a 0
转化 ab 3ab 2ab
平衡 a-ab 3a-3ab 2ab
$\left\{\begin{array}{l}{\frac{2ab}{a-ab+3a-3ab+2ab}×100%=20%}\\{2ab=0.2}\end{array}\right.$
解得$\left\{\begin{array}{l}{a=0.3}\\{b=\frac{1}{3}}\end{array}\right.$,据此计算平衡常数K;
化学平衡常数K=$\frac{(2ab)^{2}}{(a-ab).(3a-3ab)^{3}}$=0.93,故D正确;
故选AD;
(2)混合溶液呈中性,所以c(H+)=c(OH-),根据电荷守恒得c(NH4+)+c(H+)=2c(SO42-)+c(OH-),则c(NH4+)=2c(SO42-),故答案为:=;
(3)I.2NH3(g)+CO2(g)═H2NCOONH4(s)△H1=-272kJ•mol-1;
H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H2=+138kJ•mol-1;
则将两个方程式相加可得:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s)△H=△H1+△H2=-272kJ•mol-1+138kJ•mol-1=-134kJ/mol;
故答案为:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s)△H=-134kJ/mol;
II.①合成尿素总反应的快慢由第二步反应决定,
故答案为:二;
②在0~10min内,第一步反应的速率v(CO2)=$\frac{\frac{1-0.26}{0.5}}{10}$ mol•L-1•min-1=0.148mol•L-1•min-1,v(NH3)=2v(CO2)=2×0.148mol•L-1•min-1=0.296mol•L-1•min-1,
故答案为:0.296;
③第二步的正反应是吸热反应,升高温度平衡正向移动,平衡常数增大,其图象为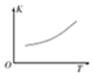 ,
,
故答案为: ;
;
(4)该燃料电池中,通入氨气的电极是负极,通入氧气的电极是正极,负极上氨气失电子和氧离子反应生成氮气和水,正极上氧气得电子生成氧离子,负极反应式为2NH3-6e-+3O 2-=N2+3H2O,
故答案为:负极;2NH3-6e-+3O 2-=N2+3H2O.
点评 本题考查较综合,涉及盖斯定律、原电池原理、化学平衡计算、化学平衡移动影响因素等知识点,为高频考点,侧重考查学生分析、计算及知识综合运用能力,注意:化学平衡常数只与温度有关,与物质转化率及物质浓度都无关,难点是电极反应式的书写,题目难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
 A、B的结构简式如图:
A、B的结构简式如图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)(△H<0)
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)(△H<0)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
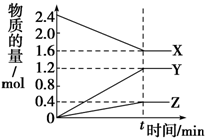 在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.
在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.| A | B | C | |
| 反应开始时浓度(mol/L) | 4.8 | 0 | |
| 2min后的浓度(mol/L) | 1.2 | 0.8 | |
| 2min内的浓度的变化(mol/L) | 0.4 | ||
| 化学学反应速率[mol/(L•min)] | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 活性炭/mol | NO/mol | A/mol | B/mol | ρ/Mpa | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 | ρ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com