
【题目】某反应的ΔH=+100 kJ·mol-1,下列有关该反应的叙述正确的是
A.正反应活化能小于100 kJ·mol-1B.逆反应活化能一定小于100 kJ·mol-1
C.正反应活化能大于100 kJ·mol-1D.正反应活化能比逆反应活化能小100 kJ·mol-1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述中错误的是
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池的电极材料不一定参与电极反应
C.在原电池中,电子流出的一极是负极,发生氧化反应
D.原电池放电时,电流的方向是从正极到负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)汽车尾气脱硝脱碳主要原理为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) +Q(Q>0)。一定条件下密闭容器
N2(g)+2CO2(g) +Q(Q>0)。一定条件下密闭容器
中,用传感器测得该反应在不同时间 NO 和 CO 浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/molL-1 | 9.50×10-3 | 4.50×10-3 | 2.50×10-3 | 1.50×10-3 | 1.50×10-3 |
c(CO)/molL-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
完成下列填空:
(1)写出该反应的平衡常数表达式:_________。 温度升高,二氧化碳气体的浓度将______(填“变大”、“变小”或“不变”)。
(2)前 2s 内的氮气的平均反应速率是:v(N2)=______mol/(Ls);达到平衡时,CO 的转化率为:_____。
(3)工业上常采用“ 低温臭氧氧化脱硫脱硝” 技术来同时吸收 SO2 和氮的氧化物气体(NOx),以获得(NH4)2SO4 的稀溶液。在此溶液中,水的电离程度是受到了_____(填“促进”、“抑制”或“没有影响”);
若往(NH4)2SO4溶液中再加入少量稀盐酸,则c(NH4+)/c(SO42-)值将_____(填“变大”、“变小”或“不变”)。
(4)如果向 BaCl2 溶液中通入足量 SO2 气体,没有沉淀生成,继续滴加一定量的氨水后,则会生成白色沉淀。用平衡移动原理解释上述现象:___________________________。
(5)向另一种可溶性钡盐溶液中通入少量SO2气体,会立即看到白色沉淀。该沉淀的化学式为_____; 原可溶性钡盐可能是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 硫酸钠溶液和醋酸铅溶液均能使蛋白质变性
B. 油脂是高级脂肪酸的甘油酯,在常温下均呈固态
C. CH3CH(NH2)COOH既能与盐酸反应、又能与氢氧化钠溶液反应
D. 合成橡胶![]() 的单体之一是CH3-C≡C-CH3
的单体之一是CH3-C≡C-CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是有机合成中的重要原料。实验室制备溴乙烷(C2H5Br,沸点38.4℃)的装置如图所示,其实验步骤为:①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;②向仪器a中加入10mL 95%乙醇、28mL 92%浓硫酸,然后加入适量溴化钠和几粒碎瓷片;③在45~50℃加热2h,使其充分反应。回答下列问题:
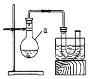
(1)仪器a的名称是________。
(2)在大烧杯中加入冰水的目的是________。
(3)加入碎瓷片的作用是________。
(4)为了更好的控制温度,选择常用的加热方式为________。
(5)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为________,生成的无色刺激性气味气体的分子式为________。
(6)U形管内可观察到的现象是_____________。
(7)反应结束后,U形管内粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可以选择下列试剂中的________(填序号)。
A.Na2SO3溶液 B.H2O C.NaOH溶液 D.苯
(8)检验溴乙烷中溴元素的实验步骤是:取少量溴乙烷于试管中,加入NaOH溶液,加热煮沸一段时间,冷却,________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2可以用Fe(NO3)3溶液吸收,某学习小组按如图装置展开探究:
取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。
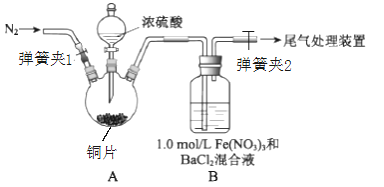
回答下列问题:
(1)装置A中用于添加浓硫酸的仪器名称为_______;检查图中连通装置A、B气密性的方法是___。
(2)加入浓硫酸之前先通入N2一段时间,其目的是___________;排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是____________;若用NaOH溶液处理尾气,则发生反应的离子方程式为______________。
(3)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置B中参与了反应
假设2:______________
假设3:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0 mol·L-1 Fe(NO3)3溶液的pH ② ____________________ ③ ____________________ ④ ___________________ | ____________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述中正确的是( )
A. 92gNO2和N2O4混合气体中含有的原子数为3NA
B. 71g氯气与足量铁粉充分反应,转移的电子数为3 NA
C. 0.5mol·L-1的Ba(OH)2溶液中OH-的数目为NA
D. 1 mol Mg与足量的O2或N2反应生成MgO或Mg3N2时,失去的电子数均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如图所示:
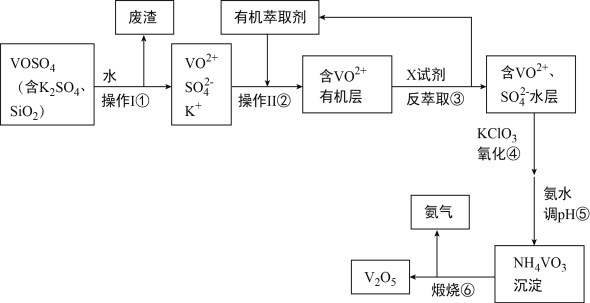
回答下列问题:
(1)步骤①所得废渣与强碱反应得离子方程式_______________________________,操作Ⅱ的名称是_______________________。
(2)步骤②、③的变化过程表示为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4(水层,X试剂为__________(写化学式)。
2RAn(有机层)+nH2SO4(水层,X试剂为__________(写化学式)。
(3)按要求完成下列方程式。④的离子方程式为__________________,其中氧化剂与氧化产物的物质的量之比为_____________,若有245gKClO3参与反应时,转移的电子数目为__________。加氨水调节pH过程中涉及的离子方程式为:__________________________________。
(4)该工艺流程中可以循环利用的物质有_________________和_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com