
| A、盐酸中滴加氨水至中性,溶质为氯化铵 |
| B、稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 |
| C、饱和石灰水中加入少量CaO,恢复至原温后溶液的pH值不变 |
| D、向沸水中滴加适量饱和FeCl3溶液,可制得红褐色带电的胶体 |


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
| 序号 | A | B | C | D |
| 实验目的 | NaOH溶液与泥沙分离 | 从浓食盐水中得到氯化钠晶体 | 提纯碘水中的I2 | 分离乙醇与水 |
| 分离方法 | 过滤 | 蒸馏 | 萃取、分液 | 蒸馏 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、b>a>m |
| B、m>b>a |
| C、a>m>b |
| D、a>b>m |
查看答案和解析>>
科目:高中化学 来源: 题型:
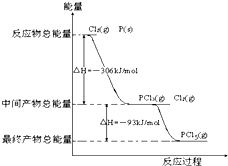 红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Cl-)>c(H-)>c(NH4+)>c(OH-) |
| B、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、c(Cl-)>c(OH-)>c(NH4+)>c(H+) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
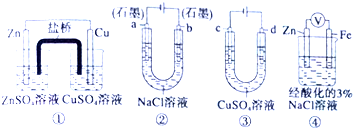
| A、装置①中,盐桥中的K+移向ZnSO4溶液 |
| B、用装置③精炼铜时,c极为粗铜 |
| C、装置②工作一段时间后,a极附近溶液的pH增大 |
| D、装置④中电子Zn流向Fe,装置中有Fe2+生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com