
| A. | $\frac{1000Vρ}{22400+36.5V}$ mol/L | B. | $\frac{Vρ}{22400}$ mol/L | ||
| C. | $\frac{Vρ}{22400+36.5}$ mol/L | D. | $\frac{V}{22.4}$ mol/L |
分析 根据n=$\frac{V}{{V}_{m}}$计算出标况下VLHCl气体的物质的量,已知配制的溶液体积为1L,然后根据c=$\frac{n}{V}$计算该盐酸的物质的量浓度即可.
解答 解:标准状况VLHCl的物质的量为:n(HCl)=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,
配制的溶液体积为1L,
则该盐酸的物质的量浓度为:c(HCl)=$\frac{\frac{V}{22.4}mol}{1L}$=$\frac{V}{22.4}$mol/L,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式即可解答,注意题中配制的是1L溶液,不是加入1L水,为易错点.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.56L | B. | 1.12L | C. | 2.24L | D. | 3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3 和HCl混合溶液 | |
| B. | 正极为C,负极为Fe,电解质溶液为Fe(NO3)3 和HNO3混合溶液 | |
| C. | 正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 和H2SO4混合溶液 | |
| D. | 正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 和HCl混合溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
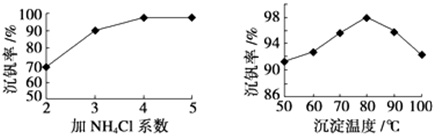
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 滴定次数 | 1 | 2 | 3 |
| 消耗Na2S2O3溶液(mL) | 19.98 | 21.18 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
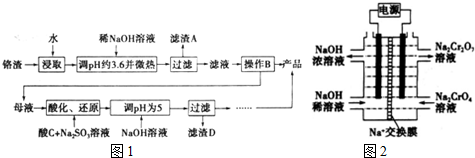
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
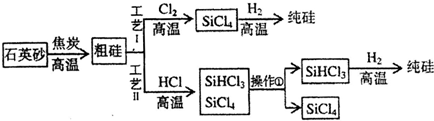
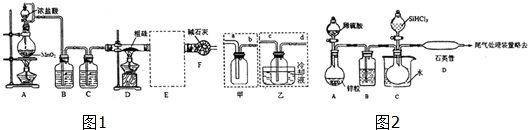
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
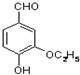 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.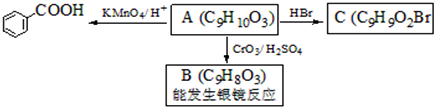
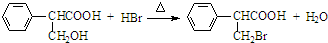 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
.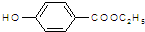 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用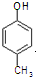 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).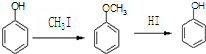

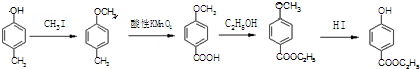
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
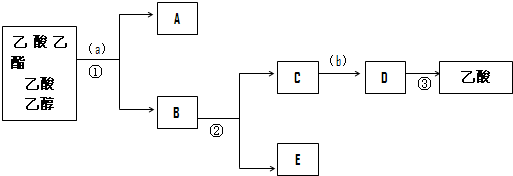
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com