
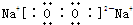
分析 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A原子核内无中子,则A为H元素;A和E同主族,结合原子序数可知E为Na;B与D最外层电子数之比为2:3,由原子序数可知,二者都处于第二周期且不相邻,故B、D原子最外层电子数分别为4、6,可推知B为C元素、D为O元素,C的原子序数介于碳、氧之间,则C为N元素;D和F同主族,则F为S元素,据此解答.
解答 解:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A原子核内无中子,则A为H元素;A和E同主族,结合原子序数可知E为Na;B与D最外层电子数之比为2:3,由原子序数可知,二者都处于第二周期且不相邻,故B、D原子最外层电子数分别为4、6,可推知B为C元素、D为O元素,C的原子序数介于碳、氧之间,则C为N元素;D和F同主族,则F为S元素.
(1)由上述分析可知,A为氢元素;E为Na元素,处于周期表中第三周期ⅠA族,
故答案为:氢;第三周期ⅠA族;
(2)非金属性O>S>C,故C、O、S元素氢化物的稳定性H2O>H2S>CH4,
故答案为:H2O>H2S>CH4;
(3)Na单质在足量氧气中燃烧生成的化合物为Na2O2,其电子式为: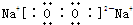 ,
,
故答案为: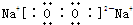 ;
;
(4)化合物X、Y均由H、O、Na、S四种元素组成,分别为NaHSO3、NaHSO4中的一种,
①NaHSO3、NaHSO4均属于离子化合物;
②X与Y的水溶液相混合发生反应的离子方程式为:H++HSO3-=H2O+SO2↑;
故答案为:离子;H++HSO3-=H2O+SO2↑;
(5)化合物Na2S的水溶液中滴入双氧水和稀硫酸,加热,生成单质为S,同时生成水,其反应离子方程式为:S2-+H2O2+2H+$\frac{\underline{\;\;△\;\;}}{\;}$S↓+2H2O,
故答案为:S2-+H2O2+2H+$\frac{\underline{\;\;△\;\;}}{\;}$S↓+2H2O.
点评 本题考查结构性质位置关系综合应用,难度不大,推断元素是解题关键,注意充分利用原子序数关系确定元素.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取用试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 把NaOH固体放在托盘天平左盘的滤纸上称量 | |
| C. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸和硝酸银溶液 | B. | 氢气在氯气中燃烧 | ||
| C. | 钠与氧气的反应 | D. | 一氧化碳在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CO(NH2)2+H2O.开始以氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为40%.
CO(NH2)2+H2O.开始以氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为40%.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:X(g)+3Y(g)?2Z(g)△H=-192kJ•mol-1.向M、N中都通入a mol X和b mol Y的混合气体,初始时M、N两容器的容积相同,保持两容器的温度相同且恒定不变.下列说法一定正确的是( )
如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:X(g)+3Y(g)?2Z(g)△H=-192kJ•mol-1.向M、N中都通入a mol X和b mol Y的混合气体,初始时M、N两容器的容积相同,保持两容器的温度相同且恒定不变.下列说法一定正确的是( )| A. | 平衡时,X的体积分数:M<N | |
| B. | 若向N中再充入a mol X和b mol Y,则平衡时,X的转化率:M<N | |
| C. | 若a:b=1:3,当M中放出172.8 kJ热量时,X的转化率为90% | |
| D. | 若a=1.2,b=1,并且N中达到平衡时体积为2 L,此时含有0.4 mol Z,则再通入0.36 mol X时,v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,温度计水银球应插入到液体中 | |
| B. | 萃取操作时,应选择溶质在其中更易溶的溶剂作萃取剂,且萃取剂与原溶剂互不相溶,其密度比原溶剂要大 | |
| C. | 用固体NaOH配制一定物质的量浓度的NaOH溶液,将NaOH固体溶于水后,立即将溶液转移到容量瓶中 | |
| D. | 称取28.6gNa2CO3•10H2O溶于水配制成100 mL1mol•L-1的Na2CO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com