
| A. | ①②③④ | B. | ②③④ | C. | ①③④ | D. | ②③ |
分析 中学常见既能和酸反应又能和碱反应的化合物有:两性氧化物、两性氢氧化物、弱酸的酸式盐、弱酸弱碱盐、氨基酸、蛋白质等.
解答 解:①Al能与酸、碱反应,但属于单质,不符合题意,故①错误;
②Al2O3为两性氧化物,与酸反应:Al2O3+6HCl=2AlCl3+3H2O,也能与碱反应:Al2O3+2NaOH=2NaAlO2+H2O,故②正确;
③Al(OH)3 为两性氢氧化物,与酸反应:Al(OH)3+3HCl=AlCl3+3H2O,也能与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O,故③正确;
④NaHCO3为弱酸的酸式盐,与酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑,也能与碱反应:NaHCO3+NaOH=Na2CO3+H2O,故④正确.
故选B.
点评 本题考查元素化合物性质,题目难度不大,注意掌握既能和酸反应又能和碱反应的物质类型,有利于基础知识的巩固.


 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 属于放热反应 | B. | 属于氧化还原反应 | ||
| C. | 由热能转化为化学能 | D. | 可用于工业生产熟石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 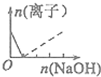 | B. | 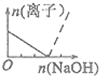 | C. | 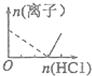 | D. | 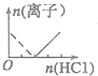 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定熔融氢氧化钠的导电性,可将氫氧化钠固体放在石英坩埚中加热熔化 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计箅机芯片的材料是经提纯的二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
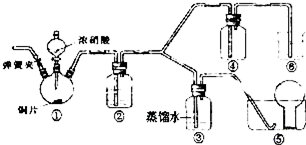
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时仰视刻度线 | |
| B. | 定容后摇匀、静置,发现液面低于刻度线,又加水至刻度线 | |
| C. | 烧杯中的溶液未冷却至室温就将溶液移到容量瓶中 | |
| D. | 容量瓶洗涤后仍有少量残留 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
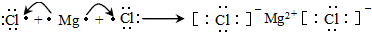 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍、镁、钙、锶、钡等碱土金属元素,在自然界都以化合态存在 | |
| B. | 从元素周期表知道,现在已经发现了113种原子 | |
| C. | 室温时,0族元素的单质都是气体 | |
| D. | 第三周期的主族元素原子的最高正价数与原子最外层电子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com