

 ,这一反应是放热(填“吸热”、“放热”)反应;元素②和④形成化合物电子式为
,这一反应是放热(填“吸热”、“放热”)反应;元素②和④形成化合物电子式为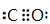 、
、 ;
;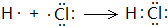 ;
; 分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne,⑨为Cl、⑩为B.
(1)氧元素非金属性很强,容易获得电子;比元素Ne质子数多16的元素为26号元素,结合核外电子排布确定其周期表中位置;
(2)元素非金属性越强,对应氢化物越稳定;
(3)氨气与硝酸反应生成硝酸铵;
(4)钠在空气中燃烧生成Na2O2,燃烧属于放热反应,元素②和④形成化合物为CO、CO2,CO与N2互为等电子体,分子中C原子与O原子之间形成3对共用电子对,CO2分子中C原子与氧原子之间形成2对共用电子对;
(5)①与⑨反应得到的化合物为HCl,属于共价化合物;
(6)某元素R的气态氢化物为HXR,8.5g的HXR气体在标准状态下的体积是5.6L,其物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,则相对分子质量为$\frac{8.5}{0.25}$=34,R在该氢化物中的质量分数为94%,则$\frac{x}{34}$=1-94%,解得x=2,故R相对原子质量为34-2=32,则R为S元素.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne,⑨为Cl、⑩为B.
(1)元素⑩为硼元素,氧元素非金属性很强,容易获得电子,具有氧化性;比元素Ne质子数多16的元素为26号元素,核外电子排布为1s22s22p63s23p63d64s2,处于周期表中第四周期Ⅷ族,
故答案为:硼;氧化性;第四周期Ⅷ族;
(2)非金属性P<S<O,元素非金属性越强,对应氢化物越稳定,故氢化物稳定性:PH3<H2S<H2O,
故答案为:PH3<H2S<H2O;
(3)氨气与硝酸反应生成硝酸铵,反应方程式为:NH3+HNO3=NH4NO3,
故答案为:NH3+HNO3=NH4NO3;
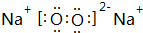
(4)钠在空气中燃烧生成Na2O2,电子式为 ,燃烧属于放热反应,元素②和④形成化合物为CO、CO2,CO与N2互为等电子体,分子中C原子与O原子之间形成3对共用电子对,电子式为
,燃烧属于放热反应,元素②和④形成化合物为CO、CO2,CO与N2互为等电子体,分子中C原子与O原子之间形成3对共用电子对,电子式为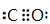 ,CO2分子中C原子与氧原子之间形成2对共用电子对,电子式为
,CO2分子中C原子与氧原子之间形成2对共用电子对,电子式为 ,
,
故答案为: ;放热;
;放热;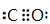 、
、 ;
;
(5)①与⑨反应得到的化合物为HCl,属于共价化合物,用电子式表示其形成过程为: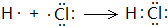 ,
,
故答案为: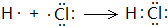 ;
;
(6)某元素R的气态氢化物为HXR,8.5g的HXR气体在标准状态下的体积是5.6L,其物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,则相对分子质量为$\frac{8.5}{0.25}$=34,R在该氢化物中的质量分数为94%,则$\frac{x}{34}$=1-94%,解得x=2,故R相对原子质量为34-2=32,则R为S元素,HXR的化学式为H2S,
故答案为:H2S.
点评 本题考查元素周期表与元素周期律综合应用,侧重考查学生对知识的迁移应用,注意掌握用电子式表示化学键或物质的形成.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾 | B. | 氯化铁 | C. | 浓溴水 | D. | 水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
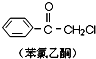 ,则苯氯乙酮不可能具有的化学性质是ce(填字母序号).
,则苯氯乙酮不可能具有的化学性质是ce(填字母序号).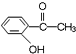 乙:
乙: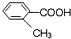 丙:
丙: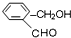
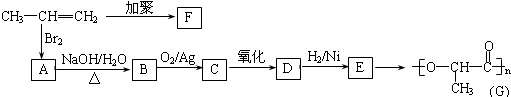
 .
. .
.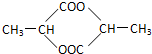 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
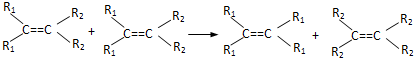
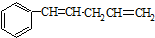 发生烯烃的复分解反应时,不可能生成的产物是( )
发生烯烃的复分解反应时,不可能生成的产物是( )| A. | 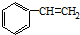 | B. | 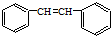 | C. | CH2=CHCH3 | D. | 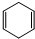 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入澄清石灰水中制漂白粉 | B. | 用硫黄制硫酸 | ||
| C. | CO2通入氢氧化钠溶液中制Na2CO3 | D. | H2和Cl2光照制HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

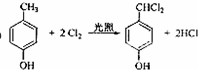 ,该反应类型为取代反应.
,该反应类型为取代反应.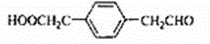 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠受热分解 | B. | 氨气与氯化氢气体反应 | ||
| C. | C(s,石墨)+H2O(g)═CO(g)+H2(g) | D. | 液态水气化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com