
| 9g |
| 12g/mol |
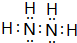 ��
��| 1mol��32g/mol |
| 12.8g |
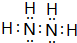 ��NaClO+2 NH3�TN2H4+NaCl+H2O��NaCl��N2H4��g��+2H2O2��l��?N2��g��+4H2O��g����H=-641.65 kJ?mol-1��
��NaClO+2 NH3�TN2H4+NaCl+H2O��NaCl��N2H4��g��+2H2O2��l��?N2��g��+4H2O��g����H=-641.65 kJ?mol-1��| 9g |
| 12g/mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���������� | ���� | |
| A | ��Һ�м������ᣬ����ʹ����ʯ��ˮ����ǵ���ɫ��ζ���� | ��Һ��һ������CO32- |
| B | ij��Һ�м�����������������ɫ���� | ��Һ��һ������Cl- |
| C | �ýྻ��˿պȡij��Һ�ڻ��������գ�����ʻ�ɫ | ��Һ����Na+����K+ |
| D | ��ij��Һ���ȼ�KSCN�����������ٵ���ˮ����Һ��� | ��Һ��һ������Fe2+ |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1 mol?L-1��NH4Cl��Һ�У�c��Cl-����c��NH4+����c��OH-����c��H+�� |
| B���������ơ���������Һ��Ϻ���Һ�����ԣ����Ϻ����Һ�У�c��Na+����c��Cl-�� |
| C����֪Ka��HF��=7.2��10-4��Ka��HCN��=6.2��10-10���������Ũ�ȵ�NaF��NaCN��Һ�У�ǰ����������С�ں��� |
| D��Ũ�Ⱦ�Ϊ0.1 mol?L-1�Ģ٣�NH4��2CO3 �ڣ�NH4��2SO4 �ۣ�NH4��2Fe��SO4��2��Һ�У�c��NH4+���Ĵ�С˳��Ϊ���ۣ��ڣ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| SiH4 | Si2H6 | Si3H8 | Si4H10 | |
| �۵㣨�棩 | -185 | -132.5 | -117.4 | -84.3 |
| �е㣨�棩 | -111.9 | -14.5 | 52.9 | 107.4 |
| �۵�ʱ�ܶȣ�g/cm3�� | 0.68 | 0.69 | 0.725 | 0.79 |
| ��ȼ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �л���A��һ����Ҫ�����������м��壬��֪�ṹ��ʽ��ͼ��
�л���A��һ����Ҫ�����������м��壬��֪�ṹ��ʽ��ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��4.48L |
| B��5.6L |
| C��6.72L |
| D��13.44L |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com