
| A、1.6 g CH4中含有的电子数 |
| B、100 mL 1 mol/L H2SO4中含有的H+数 |
| C、24 g Mg与足量稀盐酸反应转移的电子数 |
| D、标准状况下,22.4 L CO气体中含有的原子数 |


科目:高中化学 来源: 题型:
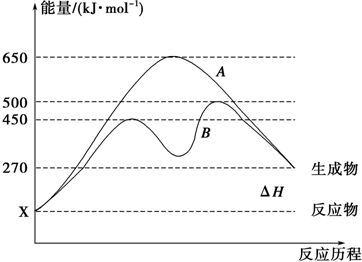
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y最高价氧化物的化学式为YOm |
| B、a+n=b-m |
| C、原子半径:X<Y |
| D、X的氢化物的化学式为HnX |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol H2完全燃烧生成液态水时放出571.6 kJ的热 | ||
| B、1mol H2完全燃烧生成液态水时放出285.8kJ的热 | ||
| C、2个氢分子完全燃烧生成液态水时放出571.6 kJ的热 | ||
D、上述热化学方程式可表示为H2(g)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol 硫酸钾中阴离子所带电荷数为NA |
| B、28g以任意比组成的CO与N2混合气体中含有2NA个原子 |
| C、5.6g Fe与足量盐酸反应,转移的电子数为0.3NA |
| D、将0.1mol氯化钠溶于1L水中,所得溶液浓度为0.1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为防止电池中的重金属元素污染土壤和水体,应积极开发废电池的综合利用技术 |
| B、利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| C、为了防止白色污染,应废止对塑料的研制和使用 |
| D、误食重金属盐后,应采取的有效应急措施是喝大量的豆浆或牛奶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com