
·ÖĪö X”¢Y”¢Z”¢WĪŖ¶ĢÖÜĘŚµÄĖÄÖÖŌŖĖŲ£¬Ęä×īøßÕż¼ŪŅĄ“ĪĪŖ+1”¢+4”¢+5”¢+7£¬ŌņX”¢Y”¢Z”¢W·Ö±šĪ»ÓŚµŚ¢ńA×唢¢ōA×唢¢õA×唢¢÷A×壻ŗĖµēŗÉŹż°“ÕÕY”¢Z”¢X”¢WµÄĖ³ŠņŌö“ó£¬ÓÉÓŚYÓėZµÄŌ×Ó“ĪĶā²ćµÄµē×ÓŹżĪŖ2£¬ĖµĆ÷Y”¢Zŗ¬ÓŠĮ½øöµē×Ó²ć£¬ŌņYĪŖCŌŖĖŲ”¢ZĪŖNŌŖĖŲ£»W”¢XŌ×Ó“ĪĶā²ćµē×ÓŹżĪŖ8£¬ŌņWĪŖClŌŖĖŲ”¢XĪŖNaŌŖĖŲ£¬ŅŌ“Ė½ā“šøĆĢā£®
½ā“š ½ā£ŗX”¢Y”¢Z”¢WĪŖ¶ĢÖÜĘŚµÄĖÄÖÖŌŖĖŲ£¬Ęä×īøßÕż¼ŪŅĄ“ĪĪŖ+1”¢+4”¢+5”¢+7£¬ŌņX”¢Y”¢Z”¢W·Ö±šĪ»ÓŚµŚ¢ńA×唢¢ōA×唢¢õA×唢¢÷A×壻ŗĖµēŗÉŹż°“ÕÕY”¢Z”¢X”¢WµÄĖ³ŠņŌö“ó£¬ÓÉÓŚYÓėZµÄŌ×Ó“ĪĶā²ćµÄµē×ÓŹżĪŖ2£¬ĖµĆ÷Y”¢Zŗ¬ÓŠĮ½øöµē×Ó²ć£¬ŌņYĪŖCŌŖĖŲ”¢ZĪŖNŌŖĖŲ£»W”¢XŌ×Ó“ĪĶā²ćµē×ÓŹżĪŖ8£¬ŌņWĪŖClŌŖĖŲ”¢XĪŖNaŌŖĖŲ£®
£Ø1£©ÓÉÉĻŹö·ÖĪöæÉÖŖ£¬XĪŖÄĘ£¬YĪŖĢ¼£¬¹Ź“š°øĪŖ£ŗÄĘ£»Ģ¼£»
£Ø2£©ZŌŖĖŲµÄĘųĢ¬Ēā»ÆĪļĪŖNH3£¬Ęä×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļĪŖHNO3£¬¶žÕß·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖNH3+HNO3ØTNH4++NO3-£¬
¹Ź“š°øĪŖ£ŗNH3+HNO3ØTNH4++NO3-£»
£Ø3£©WĪŖ Cl£¬ŌŖĖŲµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļĪŖøßĀČĖį£¬ÓėX×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļ¼“ĒāŃõ»ÆÄĘ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖH++OH-=H2O£¬
¹Ź“š°øĪŖ£ŗH++OH-=H2O£®
µćĘĄ ±¾Ģāæ¼²é½į¹¹ŠŌÖŹĪ»ÖĆ¹ŲĻµÓ¦ÓĆ£¬ĪŖøßĘµæ¼µć£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦µÄæ¼²é£¬ÕżČ·ĶʶĻŌŖĖŲµÄÖÖĄąĪŖ½ā“šøĆĢāµÄ¹Ų¼ü£¬ÓŠĄūÓŚ»ł“”ÖŖŹ¶µÄ¹®¹Ģ£®


 Ē§ĄļĀķ×ßĻņ¼ŁĘŚĘŚÄ©·ĀÕęŹŌ¾ķŗ®¼ŁĻµĮŠ“š°ø
Ē§ĄļĀķ×ßĻņ¼ŁĘŚĘŚÄ©·ĀÕęŹŌ¾ķŗ®¼ŁĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | C£Øs£©+O2£Øg£©ØTCO£Øg£©£»”÷H=-393.5 kJ/mol | |
| B£® | 2H2£Øg£©+O2£Øg£©ØT2H2O£Øg£©£»”÷H=+571.6 kJ/mol | |
| C£® | CH4£Øg£©+2O2£Øg£©ØTCO2£Øg£©+2H2O£Øg£©£»”÷H=-890.3 kJ/mol | |
| D£® | $\frac{1}{2}$C6H12O6£Øs£©+3O2£Øg£©ØT3CO2 £Øg£©+3H2O£Øl£©£»”÷H=-1400 kJ/mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ģ¼ĖįÄĘČÜŅŗÓėŃĪĖį·“Ó¦£ŗNa2CO3+2H+ØT2Na++H2O+CO2”ü | |
| B£® | Ńõ»ÆĶÓėĮņĖįČÜŅŗ·“Ó¦£ŗCu2++2H+ØTCu2++H2O | |
| C£® | ŠæÓėĻ”ĮņĖį·“Ó¦£ŗZn+2H+ØTZn2++H2”ü | |
| D£® | ĮņĖįĶČÜŅŗÖŠ·ÅČėĢśĘ¬£ŗ3Cu2++2FeØT2Fe3++3Cu |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ba£ØOH£©2•8H2OÓėNH4Cl·“Ó¦ | B£® | Ėį¼īÖŠŗĶ·“Ó¦ | ||
| C£® | ×ĘČȵÄĢæÓėCO2·“Ó¦ | D£® | H2ÓėCl2Č¼ÉÕ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
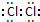 £»
£»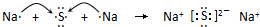 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
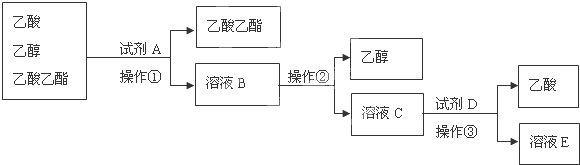
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | v£ØH2£©=0.06 mol/£ØL•min£© | B£® | v£ØNH3£©=0.02 mol/£ØL•min£© | ||
| C£® | v£ØNH3£©=0.04 mol/£ØL•min£© | D£® | v£ØN2£©=0.04 mol/£ØL•min£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com