
| A. | 过滤 | B. | 渗析 | C. | 蒸发结晶 | D. | 分液 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
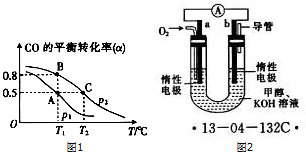
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
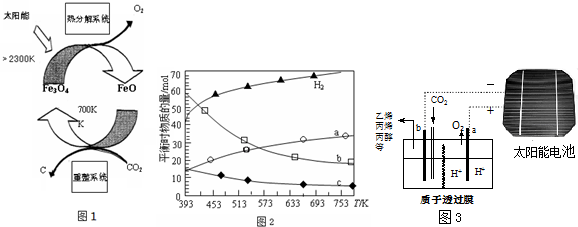
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
)的方法中,原子经济性最好的是(反应均在一定条件下进行)( )| A. | 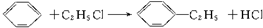 | B. |  | ||
| C. | 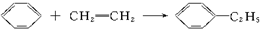 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2SiO3可用作助燃剂 | B. | SiO2可用作制造光导纤维 | ||
| C. | 单晶硅可用于制造太阳能电池 | D. | Si可用作制造变压器铁芯的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P4和CH4分子的立体构型都是正四面体形且键角都为109°28' | |
| B. | NaCl晶体中与每个Na+距离相等且最近的Na+共有6个 | |
| C. | 单质的晶体中一定不存在阴离子 | |
| D. | SO2、BF3、NC13分子中所有原子的最外层电子均未达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
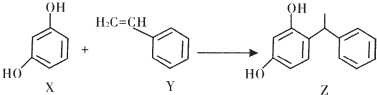
| A. | l mol X中位于同一平面的原子数目最多为14NA | |
| B. | 0.5 molY最多可与44.8 L H2发生加成反应 | |
| C. | l moI Y完全燃烧消耗氧气的分子数为8NA | |
| D. | 1 mol Z中碳碳双键的数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
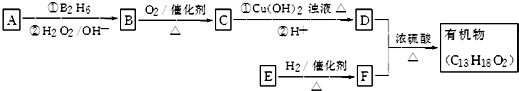
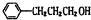 .
.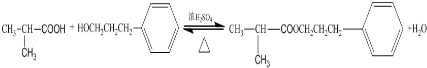 ;其反应类型是取代反应.
;其反应类型是取代反应.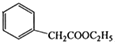 )是一种重要的医药中间体.写出以苯乙酮(
)是一种重要的医药中间体.写出以苯乙酮(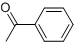 )和乙醇为主要原料制备苯乙酸乙酯的合成路线流程图(无机试剂任选).
)和乙醇为主要原料制备苯乙酸乙酯的合成路线流程图(无机试剂任选).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com