
【题目】我国科研人员研究了在 Cu-ZnO-ZrO2 催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+*H,带*标记的物质是该反应历程中的中间产物或过渡态)。下列说法错误的是
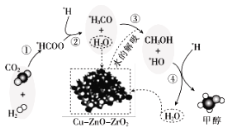
A.第①步中CO2和H2分子中都有化学键断裂
B.水在整个历程中可以循环使用,整个过程不消耗水也不产生水
C.第③步的反应式为:*H3CO+H2O→CH3OH+*HO
D.第④步反应是一个放热过程
科目:高中化学 来源: 题型:
【题目】贝壳、珍珠、方解石等主要成分均含有CaCO3,回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧碳酸钙时的焰色为_______(填标号)。
A 黄色 B 红色 C 紫色 D 绿色
(2)CaCO3中三种元素第一电离能由小到大的顺序是__________。CaCO3中的化学键除了σ键外,还存在_________________。
(3)关于CO2和CO32-的下列说法正确的是__________。
a 两种微粒价层电子对数相同 b 两种微粒的中心原子均无孤电子对
c 键角:CO2>CO32- d 两种微粒的中心原子杂化方式相同
(4)难溶碳酸盐易分解,CaCO3、BaCO3热分解温度更高的是_____,原因是______。
(5)方解石的菱面体结构如图1,沿三次轴的俯视图为正六边形。方解石的六方晶胞结构如图2,晶胞底面为平行四边形,其较小夹角为60°,边长为anm,晶胞高为c nm。
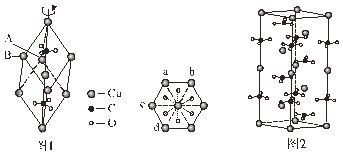
A点在俯视图中为a,则B点在俯视图中的位置为_________(填字母)。方解石的六方晶胞中,Ca2+和CO32-个数比为___________;若阿伏加德罗常数为NA,则该方解石的密度为________g/cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:
2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4__________H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:____________________。

(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42残留,原因是__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的质量分数是________。(已知:H3PO4摩尔质量为98 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
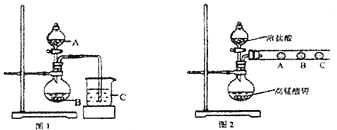
【题目】Ⅰ、某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
(1)甲同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其设计的依据是 ;但该装置存在缺陷,请指出 。
(2)乙同学设计了如图2装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。乙同学可能观察到的现象
A. ;B. ;C. 。
从环保角度考虑,该装置有明显不足,请指出提出改进建议 。
Ⅱ、另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。
步骤一:电解精制:电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
序号 | 反应 | 平衡常数 |
1 |
|
|
2 |
|
|
请根据以上信息简要解释溶解阳极泥不用王水的原因 。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程。
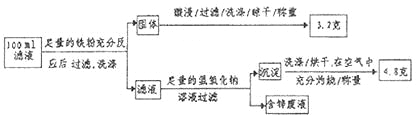
则![]() 滤液中
滤液中![]() 的浓度为
的浓度为 ![]() ,
,![]() 的浓度为
的浓度为 ![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫的氧化物的综合利用是目前研究的热点之一。回答下列问题:
I.NO2可以分解成物质的量之比为1:1的两种氮的氧化物,,其中还原产物的化学式可能为___。
II.已知:
i.N2(g)+O2(g)![]() 2NO(g) △H=+180.0 kJ·mol-1
2NO(g) △H=+180.0 kJ·mol-1
ii.2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
iii.2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0 kJ·mol-1
2NO2(g) △H=-113.0 kJ·mol-1
(1)反应iV:2NO2(g)+2SO2(g)![]() 2SO3(g)+N2(g)+O2(g)的 △H=__________;该反应在密闭容器中达到平衡后,只改变下列条件,一定能使N2的平衡体积分数增大的是__________(填选项字母)。
2SO3(g)+N2(g)+O2(g)的 △H=__________;该反应在密闭容器中达到平衡后,只改变下列条件,一定能使N2的平衡体积分数增大的是__________(填选项字母)。
A.缩小容器容积 B.再充入SO2 C.降低温度 D.分离出SO3
(2)T1°C时,容积相等的密闭容器中分别充入NO2和SO2的混合气体4 mol,发生反应iV。NO2或SO2的平衡转化率(a)与起始充入的![]() 关系如图1所示。
关系如图1所示。
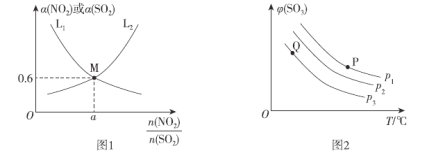
①图中能表示平衡时a(SO2)与起始充入的![]() 关系的曲线为__________(填“L1”或“L2”),理由为___________________;
关系的曲线为__________(填“L1”或“L2”),理由为___________________;
②反应的平衡常数K=________。
(3)向密闭容器中充入一定量SO2和O2,发生反应ii。SO3的平衡体积分数(φ)与温度(T)和压强(p)的关系如图2所示。
①p1、p2、p3由大到小的顺序为_______________。
②P.Q两点对应状态下,单位体积内反应物活化分子数目:P__________Q(填“>”、“<”或“=”),判断依据为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室分别用以下4个装置完成实验。下列有关装置、试剂和解释都正确的是
A.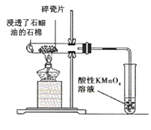 中碎瓷片为反应的催化剂,酸性KMnO4溶液褪色可证明有乙烯生成
中碎瓷片为反应的催化剂,酸性KMnO4溶液褪色可证明有乙烯生成
B. 所示装置(秒表未画出)可以测量锌与硫酸溶液反应的速率
所示装置(秒表未画出)可以测量锌与硫酸溶液反应的速率
C.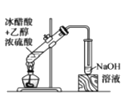 为实验室制备乙酸乙酯的实验,浓硫酸起到催化剂和脱水剂的作用
为实验室制备乙酸乙酯的实验,浓硫酸起到催化剂和脱水剂的作用
D. 为铜锌原电池装置,盐桥中的阳离子向右池迁移起到形成闭合电路的作用
为铜锌原电池装置,盐桥中的阳离子向右池迁移起到形成闭合电路的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况)。向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A. 该合金中铜与镁的物质的量之比是2:1
B. NO2和N2O4的混合气体中,NO2的体积分数是80%
C. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】山梨酸和苯甲酸都是制备防腐剂的原料,他们的键线式如图所示。下列说法正确的是( )
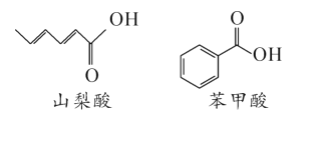
A.它们都能发生加成和氧化反应
B.苯甲酸分子中所有的原子共平面
C.山梨酸和苯甲酸互为同系物
D.山梨酸与足量H2反应后所得产物的一氯代物有6种(不考虑立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com