
| A. | ②③⑤ | B. | ①④⑤ | C. | ②③⑥ | D. | ③④⑥ |
分析 根据反应的实质为Zn+2H+═Zn2++H2↑,故要减缓反应速度,应降低溶液中H+离子的浓度,不影响生成氢气的总量,则所加入物质对溶液中与锌反应的H+离子的总物质的量没有影响.
解答 解:①加入硫酸钠固体,不影响氢离子浓度,对反应速率没有影响,故①错误;
②加入水,稀释了硫酸溶液,溶液中氢离子浓度减小,反应速率减小,但是溶液中氢离子物质的量不变,生成氢气的总量不变,故②正确;
③加入硫酸钾溶液,对硫酸的物质的量没有影响,不影响生成氢气的总量,但H+离子浓度降低,减缓反应进行的速度,故③正确;
④加入硝酸钾溶液,硝酸根离子会与氢离子形成硝酸,硝酸与金属反应也不产生氢气,氢气的总量会减少,故④错误;
⑤加入醋酸钠固体,和硫酸反应生成醋酸是弱酸,减缓反应速率,但又不影响生成氢气的总量,故⑤正确;
⑥硫酸铜固体溶解,消耗锌生成铜,锌和铜形成原电池反应加快反应速率,故⑥错误;
所以正确的有②③⑤,
故选A.
点评 本题考查外界条件对反应速率的影响,做题时注意本题中的两个要求,从物质的性质角度考虑,本题难度不大.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
 +CH3Br$\stackrel{催化剂}{→}$
+CH3Br$\stackrel{催化剂}{→}$ +HBr
+HBr
 .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$
 +
+ $→_{△}^{浓硫酸}$H2O+
$→_{△}^{浓硫酸}$H2O+
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
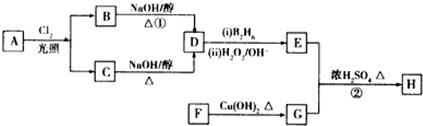
 .
. .
.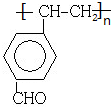 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数依次减少 | |
| B. | P、S、Cl元素最高正价依次降低 | |
| C. | Na、K、Rb的金属性依次增强 | |
| D. | N、O、F原子半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、N、O、F的原子半径依次减小 | |
| B. | Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | C、N、O、F的最高正价依次升高 | |
| D. | Na、Mg、Al、Si的最外层电子数依次增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
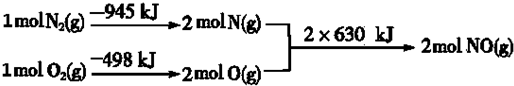
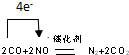 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com