
分析 溶液中c(Ac-)=0.1mol/L,根据Ka=$\frac{c({H}^{+})×c(A{c}^{-})}{c(HAc)}$计算c(H+),电离度=$\frac{已电离的醋酸的浓度}{醋酸的总浓度}$,据此分析.
解答 解:在0.1mol•L-1HAc溶液中,加入适量NaAc晶体,并使NaAc的浓度为0.1mol•L-1.溶液中c(Ac-)=0.1mol/L,
Ka=$\frac{c({H}^{+})×c(A{c}^{-})}{c(HAc)}$=$\frac{c({H}^{+})×0.1}{0.1-c({H}^{+})}$=1.76×10-3,则c(H+)≈1.76×10-3mol/L;
电离度=$\frac{已电离的醋酸的浓度}{醋酸的总浓度}$=$\frac{1.76×1{0}^{-3}}{0.1}$×100%=1.76%;
答:溶液中的[H+]为1.76×10-3mol/L及HAc的电离度是1.76%.
点评 本题考查了溶液中离子浓度的计算,题目难度不大,注意把握电离常数的含义以及有关计算,侧重于考查学生的分析能力和计算能力.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量低于生成物的总能量时,则反应释放能量 | |
| B. | 物质燃烧可看做“储存”在物质内部的能量(化学能)转化为热能释放出来 | |
| C. | 钠原子与氯原子结合生成氯化钠后,其结构的稳定性增强,体系的能量降低 | |
| D. | 当断开旧键吸收的能量大于形成新键放出的能量时,该反应为吸收能量的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,Na+、H+、Cl-、Mg2+可以大量共存 | |
| B. | 与KSCN溶液反应产生红色沉淀 | |
| C. | 加入铜粉,反应的离子方程式为:Cu+Fe3+=Cu2++Fe2+ | |
| D. | 向该溶液中滴入少量Na2S溶液,反应的离子方程式为:2Fe3++3S2-+6H2O=3H2S↑+2Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
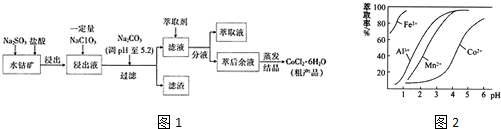
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的溶液 | B. | c(H+)=1×10-7mol/L的溶液 | ||
| C. | c(OH-)=1×10-5mol/L的溶液 | D. | pH=9的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若a>b,一定存在c(A-)=c(K+) | B. | 若a=2b,一定存在c(A-)>c(K+) | ||
| C. | 若2a=b,一定存在c(OH-)>c(A-) | D. | 若a=b,一定存在c(OH-)=c(H+)+c(HA) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com