
下列叙述不正确的是( )
| A | B | C | D |
|
|
|
|
|
| 闪电时会发生反应:N2+O2 | 利用丁达尔效应证明烧杯中的分散系是胶体 | 蔗糖中加入浓硫酸搅拌后变黑,因为浓硫酸有吸水性 | 加热时熔化的铝不滴落,证明Al2O3的熔点比Al高 |
科目:高中化学 来源: 题型:
下列说法正确的是
A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的数据
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.物质发生化学变化一定伴随着能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列不发生反应的一组物质是 ( )
①硅与NaOH溶液 ②硅与盐酸 ③硅与氢氟酸 ④二氧化硅与碳酸钠 ⑤二氧化硅与NaOH溶液 ⑥二氧化硅与浓硝酸
A.①②④ B.③④⑥ C.②⑤⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25 ℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
由此可得出
A.对应钠盐溶液pH关系为: pH(Na2CO3) > pH(NaCN) > pH(CH3COONa)
B.CO2通入NaCN溶液中有:CO2+H2O+2NaCN→Na2CO3+2HCN
C.冰醋酸中逐滴加水,溶液的导电性、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO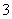 ) +2c(CO
) +2c(CO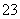 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
分类方法在化学学科的发展中起到重要的作用。下列分类标准合理的是( )
A.根据纯净物的元素组成,将纯净物分为单质和化合物
B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定条件下能大量共存的是( )
①漂白粉的水溶液中:Fe2+、Cl-、Ca2+、Na+ ②滴加石蕊试液呈红色的溶液:K+、NH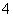 、Cl-、S2- ③能够与金属Cu常温下反应放出气体的溶液:Fe3+、Al3+、SO
、Cl-、S2- ③能够与金属Cu常温下反应放出气体的溶液:Fe3+、Al3+、SO 、K+
、K+
④常温下pH=2的溶液中:NH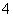 、Na+、Cl-、Cu2+
、Na+、Cl-、Cu2+
⑤无色溶液中:K+、CH3COO-、HCO 、MnO
、MnO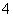
A.②③ B.①③
C.③④ D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl(浓)===2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________(填序号)。
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为________mol。
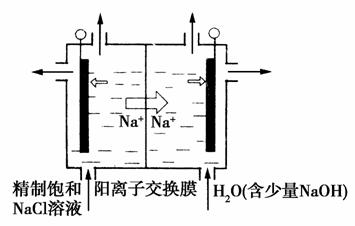
(2)目前已开发出用电解法制取ClO2的新工艺。
①如图装置用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:__________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_______
mol,用平衡移动原理解释阴极区pH增大的原因_________。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- a mol·L-1,现用ClO2将CN-氧化,有两种气体生成,其离子反应方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应的实验,能够达到实验目的的是( )
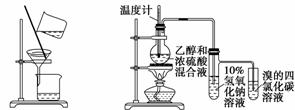
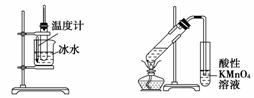
A.分离乙酸乙酯、碳酸钠和水的混合物
B.证明乙醇、浓硫酸共热生成乙烯
C. 实验室制取少量的硝基苯
D. 证明溴乙烷、NaOH、乙醇溶液共热生成乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com