
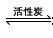 SO2Cl2(l) △H = -97.3 kJ . mol-1
SO2Cl2(l) △H = -97.3 kJ . mol-1 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
| 活性炭 |
| 1 |
| c(SO2)?c(Cl2) |
| 1 |
| c(SO2)?c(Cl2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 活性炭 |
查看答案和解析>>
科目:高中化学 来源:上海市闵行区2013年高考一模化学试题 题型:022
氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点–54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g)1.试写出常温常压下化学平衡常数K的表达式:K=________;
若在此条件下,将化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是________(选填编号).
a.降低温度
b.移走SO2Cl2
c.增加反应物浓度
d.无法满足上述条件
2.为了提高上述反应中Cl2的平衡转化率,下列措施合理的是________(选填编号).
a.缩小容器体积
b.使用催化剂
c.增加SO2浓度
d.升高温度
在100℃时,往上述平衡体系中加入37Cl2,一段时间后,则平衡体系中含有37Cl的物质有________(选填编号).
a.只有37Cl2
b.只有SO237Cl2
c.37Cl2和SO237Cl2
d.无法判断
3.下列描述中能说明上述反应已达平衡的是________(选填编号).
a.v(Cl2)=v(SO2)
b.容器中气体压强不随时间而变化
c.c(Cl2)∶c(SO2)=1∶1
d.容器中气体颜色不随时间两变化
4.300℃时,体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO27.616 g.若在上述中的平衡体系中,再加入16.20 g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是________.
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:单选题
 SO2Cl2(l),在某密闭容器中加入16. 20g氯化硫酰,达到平衡时容器中含SO2 7.616 g。反应后将平衡混合物溶于足量的BaCl2溶液中,则最终生成沉淀的质量
SO2Cl2(l),在某密闭容器中加入16. 20g氯化硫酰,达到平衡时容器中含SO2 7.616 g。反应后将平衡混合物溶于足量的BaCl2溶液中,则最终生成沉淀的质量 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com