
����Ŀ���ش��������⣺
��1����֪������CO��ȼ����Ϊ283 kJ/mo1����CO��ȼ���ȵ��Ȼ�ѧ����ʽΪ___________________________________��
��2����ҵ������CO��H2�ϳ������ԴCH3OH���䷴ӦΪ��CO(g)+2H2(g)![]() CH3OH(g) ��H=-116kJ/mo1
CH3OH(g) ��H=-116kJ/mo1
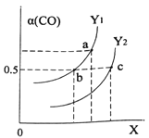
��ͼ��ʾCO��ƽ��ת����(��)���¶Ⱥ�ѹǿ�仯��ʾ��ͼ��X��ʾ����_____________��Y1_____Y2(�<������=������>��)��
��3���ϳɼ״��ķ�Ӧԭ��Ϊ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)����1L���ܱ������У�����1mol CO2��3mol H2����500���·�����Ӧ�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g)+H2O(g)����1L���ܱ������У�����1mol CO2��3mol H2����500���·�����Ӧ�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��

�ٷ�Ӧ���е�4minʱ��v(��)____v(��)(�>����<����=��)��0~4min��CO2��ƽ����Ӧ����v(CO2)=____________mol��L1��min1��
�ڸ��¶���ƽ�ⳣ��Ϊ_____________��
��������˵���÷�Ӧ�Ѵﵽƽ��״̬����______________��
A��v��(CH3OH)=3v��(H2)
B��CO2��H2��CH3OH��H2OŨ��֮��Ϊ1��3��1��1
C�����º�ѹ�£������������ٱ仯
D�����º����£�������ܶȲ��ٱ仯
��4��Ϊ���ȼ�ϵ����������ʣ����������Ϊȼ�ϵ�ء�ij����Լ���Ϊȼ�ϣ�����Ϊ��������KOH��ҺΪ�������Һ���Ծ��д����ú͵������ܵ�ϡ������Ϊ�缫��д����ȼ�ϵ�صĸ�����Ӧʽ��_____________________________��
���𰸡�CO(g)+1/2O2(g)![]() CO2(g) ��H=-283kJ/mo1 ѹǿ < > 0.125 5.33(��5.3��16/3) C CH4 - 8e- + 10 OH- = CO32-+7 H2O
CO2(g) ��H=-283kJ/mo1 ѹǿ < > 0.125 5.33(��5.3��16/3) C CH4 - 8e- + 10 OH- = CO32-+7 H2O
��������
ȼ����Ϊ1mol�����Ŀ�ȼ����ȫȼ�������ȶ��Ļ������ͷŵ����������淴Ӧ����ƽ��ʱ��ͬ�����ʵ�����������ȣ�����ֵ�Ũ�ȡ��������ֲ��䣬�ɴ�����������һЩ�����䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����仯˵������ƽ����
(1)����ȼ���ȵĸ��ȼ���ȵ��Ȼ�ѧ����ʽΪ��CO(g)+1/2O2(g)![]() CO2(g) ��H=-283kJ/mo1��
CO2(g) ��H=-283kJ/mo1��
(2) ��H<0���÷�ӦΪ���ȷ�Ӧ��������������ԭ���������¶ȣ�ƽ�������ƶ���CO��ת���ʽ��ͣ�ͼ��������Y���ߣ����ݷ��̿�֪������ѹǿ�������С��ƽ�������ƶ�����X ��ʾѹǿ����ѹǿ����ʱ�������¶ȣ�ƽ�������ƶ���CO��ת���ʽ��ͣ�Y1<Y2;
(3) ��ͨ��ͼ���֪����Ӧ��15minʱƽ�⣬4min��Ӧ������У���v(��)>v(��)��v(CO2)=![]() /
/![]() =0.5/4=0.125mol/��L��min����
=0.5/4=0.125mol/��L��min����
�ڸ��¶���ƽ�ⳣ����![]() =5.33��
=5.33��
��A.��Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ����3v��(CH3OH)=v��(H2)������v��(CH3OH)=3v��(H2)����˵��CH3OH���淴Ӧ������ͬ��A����
B.ƽ��ʱ��Ӧ������и���ֵĺ������ֲ��䣬��������CO2��H2��CH3OH��H2O��Ũ��֮�Ȳ�һ��Ϊ1: 3 :1: 1�����Բ�����Ϊƽ��ı�־��B����
C.�÷�Ӧ������������仯�ķ�Ӧ�����º�ѹ�£������������ٱ仯��������Ϊƽ��ı�־��C��ȷ��
D. ��Ӧǰ��������������䣬������������䣬�����ܶ�ʼ�ձ��ֲ��䣬��˻��������ܶȱ��ֲ��䲻����Ϊƽ��ı�־��D����
��ΪC
(4)����ȼ�ϵ���Լ���Ϊȼ�ϣ��Կ���Ϊ����������KOH��ҺΪ����ʣ������õ��ӣ��������Һ���뷴Ӧ����ط�ӦΪ��CH4 - 8e- + 10 OH- = CO32-+7 H2O��


 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����������ԭ����������
A. 64 g SO2 B. 3.01��1023��N2
C. 0.75 mol H2S D. 36 mL H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ�ϵ��������������(Westinghouse)��˾���ƿ����ġ����Թ����������������Ϊ����ʣ����ֹ��������ڸ���������������(O2��)�����ͨ�����õ�صĹ���ԭ������ͼ��ʾ�����ж�缫a��b��������缫��Ӧ�������ж���ȷ����

A. ��O2�ŵ��a��Ϊ��صĸ���
B. O2�������ص�����
C. b����Ӧ�ĵ缫��ӦΪ2H2��4e����2O2��=2H2O
D. a����Ӧ�ĵ缫��ӦΪO2��2H2O��4e��=4OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����1��Zn��s����1/2O2��g����ZnO��s�� ��H����348.3kJ��mol��1����
��2��2Ag��s����1/2O2��g����Ag2O(s)�� ��H����31.0kJ��mol��1��
��Zn��s����Ag2O��s����ZnO��s����2Ag��s���ġ�H����
A. ��317.3kJ��mol��1 B. ��379.3kJ��mol��1 C. ��332.8kJ��mol��1 D. ��317.3kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ͨ��ʵ��̽�����̼�õ���������ǿ����ͨ���Ƚ���������������Ӧˮ���������ǿ������֤���������ͼʵ�顣
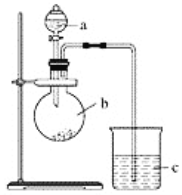
��1������a��������________��Ӧʢ������ҩƷ�е�________(����ĸ)��
A��ϡ���� B��������C�������� D������
��2������b��������________��Ӧʢ������ҩƷ�е�________(����ĸ)��
A��̼��� B�������� C���Ȼ��� D��̼����
��3������c��Ӧʢ�ŵ��Լ���________�����������������____________________��֤��b�з�Ӧ������________������֤��________��________����ǿ���õ�������________��________ǿ��b�з�����Ӧ�����ӷ���ʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�ý�����Ӧʵ�飬װ�ú������ܴﵽʵ��Ŀ�ĵ���

A. װ�â٣����Ȼ�狀�����������NH3 B. װ�âڣ��ռ�NO����
C. װ�âۣ��ӱ���ʳ��ˮ����ȡ�Ȼ��� D. װ�âܣ�̽�������ԣ�KMnO4��Cl2��I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪299 Kʱ���ϳɰ���ӦN2(g ) + 3H2 ( g )![]() 2NH3( g ) ��H =" -92.0" kJ/mol�������¶��µ�1 mol N2��3 mol H2����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������Ϊ(����������ʧ)
2NH3( g ) ��H =" -92.0" kJ/mol�������¶��µ�1 mol N2��3 mol H2����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������Ϊ(����������ʧ)
A. һ������92.0 kJ B. һ������92.0 kJ
C. һ��С��92.0 kJ D. ����ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ͨ���Ȼ�ѧѭ���ڽϵ��¶�����ˮ������ֽ��Ʊ������ķ�Ӧϵͳԭ����
ͨ�����㣬��֪ϵͳ��I����ϵͳ��II��������Ȼ�ѧ����ʽ�ֱ�Ϊ_____________________________��____________________________���Ƶõ���H2�����������ٵ���________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����H2��O2��������Na2CO3���ȼ�ϵ�أ����õ�ⷨ�Ʊ� Fe(OH)2��װ����ͼ��ʾ�����е����������Ϸֱ�Ϊ����ʯī��ͨ��һ��ʱ����Ҳಣ�����в��������İ�ɫ������������˵����ȷ����( )

A. ʯī�缫�ĵ缫��ӦʽΪO2��4e��===2O2��
B. X�����缫
C. ��������1mol Fe�ܽ⣬ʯī���H2 22.4 L
D. �������������ͨ���廥����X��Y��������ҲҪ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com