
分析 设混合溶液的体积为VL,K2SO4溶液、Al2(SO4)3溶液、纯水的体积分别为V1、V2、V3,根据K+、Al3+混合前后物质的量相等以及V1+V2+V3=V计算.
解答 解:设混合溶液的体积为VL,K2SO4溶液、Al2(SO4)3溶液、纯水的体积分别为V1、V2、V3,
根据K+、Al3+混合前后物质的量守恒可得关系式:0.1mol/L×2×V1=0.1mol/L×V,0.2mol/L×2×V2=0.1mol/L×V,
解得:V1=$\frac{1}{2}$V,V2=$\frac{1}{4}$V,
由V1+V2+V3=V可知,V3=V-V1-V2=V-$\frac{1}{2}$V-$\frac{1}{4}$V=$\frac{1}{4}$V,
所以V1:V2:V3=$\frac{1}{2}$V:$\frac{1}{4}$V:$\frac{1}{4}$V=2:1:1,
答:K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比为2:1:1.
点评 本题考查了物质的量浓度的计算,题目难度中等,把握好混合前后离子的物质的量相等是解题的关键,注意明确物质的量浓度的概念及表达式.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 原固体混合物中Cu与Cu2O的物质的量之比为1:1 | |
| B. | 原稀硝酸中HNO3的物质的量浓度为1.3mol•L-l | |
| C. | 产生的NO的体积为2.24L | |
| D. | Cu、Cu2O与硝酸反应后剩余HNO3为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe2+、SO42-、NO3- | B. | Mg2+、K+、Cl-、AlO2- | ||
| C. | Al3+、Na+、SO42-、HS- | D. | Ca2+、H+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.20gNaCl | |
| B. | 用250mL的容量瓶配制230mL的碳酸钠溶液 | |
| C. | 用25mL滴定管量取14.80mL的溶液 | |
| D. | 用pH试纸测得溶液的pH为12.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
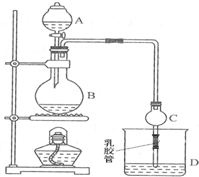 已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
 CH3COOCH2CH3+H218O.
CH3COOCH2CH3+H218O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com