
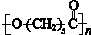 .其合成路线如下.
.其合成路线如下.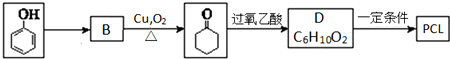

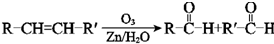
 .上述生成D的反应类型是氧化反应.
.上述生成D的反应类型是氧化反应.
 .
. 、XOHCCH2CH2CH2CH2CHO.
、XOHCCH2CH2CH2CH2CHO. 分析 苯酚与氢气加成生成环己醇B,B为 ,环己醇在Cu作催化剂的条件下氧化生成环己酮,结合信息①环己酮与过氧乙酸反应生成D,D为
,环己醇在Cu作催化剂的条件下氧化生成环己酮,结合信息①环己酮与过氧乙酸反应生成D,D为 ,
,
M的氧化产物是己二酸,则M为HOOC(CH2)5OH,M能够通过酯化反应,缩聚生成高分子化合物,E是D的同分异构体,具有相同的官能团,可知E为 ,E水解生成F,F为HOOC(CH2)3CHOHCH3,F→G为消去反应,结合信息②和G→H的反应条件可知,G为HOOCCH2CH2CH=CHCH3,H为HOOCCH2CH2CH=CHCH2Br,H水解生成K,K为HOOCCH2CH2CH=CHCH2OH,以此解答该题.
,E水解生成F,F为HOOC(CH2)3CHOHCH3,F→G为消去反应,结合信息②和G→H的反应条件可知,G为HOOCCH2CH2CH=CHCH3,H为HOOCCH2CH2CH=CHCH2Br,H水解生成K,K为HOOCCH2CH2CH=CHCH2OH,以此解答该题.
解答 解:苯酚与氢气加成生成环己醇B,B为 ,环己醇在Cu作催化剂的条件下氧化生成环己酮,结合信息①环己酮与过氧乙酸反应生成D,D为
,环己醇在Cu作催化剂的条件下氧化生成环己酮,结合信息①环己酮与过氧乙酸反应生成D,D为 ,
,
M的氧化产物是己二酸,则M为HOOC(CH2)5OH,M能够通过酯化反应,缩聚生成高分子化合物,E是D的同分异构体,具有相同的官能团,可知E为 ,E水解生成F,F为HOOC(CH2)3CHOHCH3,F→G为消去反应,结合信息②和G→H的反应条件可知,G为HOOCCH2CH2CH=CHCH3,H为HOOCCH2CH2CH=CHCH2Br,H水解生成K,K为HOOCCH2CH2CH=CHCH2OH,
,E水解生成F,F为HOOC(CH2)3CHOHCH3,F→G为消去反应,结合信息②和G→H的反应条件可知,G为HOOCCH2CH2CH=CHCH3,H为HOOCCH2CH2CH=CHCH2Br,H水解生成K,K为HOOCCH2CH2CH=CHCH2OH,
(1)B为 ,可由苯酚与氢气在Ni催化作用下加热生成,故答案为:H2,Ni/△;
,可由苯酚与氢气在Ni催化作用下加热生成,故答案为:H2,Ni/△;
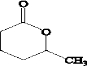
(2)D为 ,
, 被过氧乙酸氧化生成
被过氧乙酸氧化生成 ,故答案为:
,故答案为: ;氧化反应;
;氧化反应;
(3)PCL的结构可表示为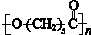 ,属于线型高分子材料,故答案为:线型;
,属于线型高分子材料,故答案为:线型;
(4)E的结构简式是 ,故答案为:
,故答案为: ;
;
(5)H为HOOCCH2CH2CH=CHCH2Br,在NaOH溶液中发生中和反应和卤代烃的水解反应,化学方程式为HOOCCH2CH2CH=CHCH2Br+2NaOH$\stackrel{△}{→}$NaOOCCH2CH2CH=CHCH2OH+NaBr+H2O,故答案为:HOOCCH2CH2CH=CHCH2Br+2NaOH$\stackrel{△}{→}$NaOOCCH2CH2CH=CHCH2OH+NaBr+H2O;
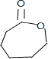
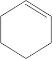
(6)苯酚与氢气加成生成环己醇,环己醇发生消去反应生成环己烯,结合题给信息,用臭氧氧化生成OHCCH2CH2CH2CH2CHO,再氧化生成己二酸,则W为 ,X为OHCCH2CH2CH2CH2CHO,
,X为OHCCH2CH2CH2CH2CHO,
故答案为: ;OHCCH2CH2CH2CH2CHO.
;OHCCH2CH2CH2CH2CHO.
点评 本题考查有机物的合成,为高频考点,和常见题型,侧重于学生的分析能力的考查,题目难度中等,解答本题注意结合题给信息和官能团的转化,特别是有机物官能团的性质,是解答该题的关键,注意借鉴题给信息进行解答.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
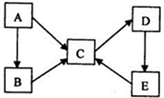 己知X、Y、Z、W为短周期四种常见元素,其中X是原子半径最小的元素,Y原子的最外层电子数是内层电子数二倍,Z能和X形成两种常见的液态化合物,W元素的单质既能与盐酸反应也能与NaOH溶液反应.元素Q是地壳中含量第二位的金属元素.试回答下列问题:
己知X、Y、Z、W为短周期四种常见元素,其中X是原子半径最小的元素,Y原子的最外层电子数是内层电子数二倍,Z能和X形成两种常见的液态化合物,W元素的单质既能与盐酸反应也能与NaOH溶液反应.元素Q是地壳中含量第二位的金属元素.试回答下列问题: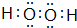 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源.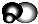 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
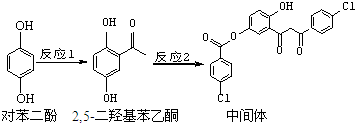
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、水解、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以焦炭和二氧化硅为原料生产单质硅 | |
| B. | 以氨气为原料生产硝酸 | |
| C. | 电解氯化镁溶液生产金属镁 | |
| D. | 电解熔融氯化钠生产金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 某溶液100mL,其中含硫酸0.03mol,硝酸0.04mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015mol | |
| B. | 室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系是a=4b+c | |
| C. | 已知某温度Ksp(Ag2S)=6×10-50,Ksp(AgCl)=2×10-6,则2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×10-37 | |
| D. | 在25℃下,将2a mol•L-1的氨水与0.02 mol•L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),则用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{10-9}{a-0.01}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键能 | 半径 | 键的极性 | 沸点 |
| H-Cl>H-I | Cl-<Br- | H-Cl>H-Br | HF>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
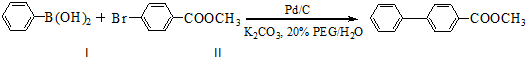

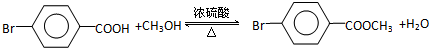 .
.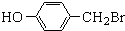 ,
,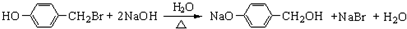
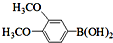 与化合物
与化合物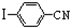 在一定条件可发生类似反应①的反应,其产物的结构简式为
在一定条件可发生类似反应①的反应,其产物的结构简式为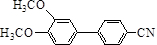 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | ||
| C. | c(NH4+)=c(Cl-)>c(H+)=c(OH-) | D. | c(NH4+)=c(Cl-)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com