
| A. | 单质活泼性:C2>B2>A2 | B. | 还原性:A->B->C- | ||
| C. | 氧化性:A2>B2>C2 | D. | 反应:A2+2C-=2A-+C2不能发生 |
分析 氧化还原反应中氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物,标注反应过程中元素化合价变化分析判断氧化剂、还原剂、还原产物、氧化产物,利用规律分析判断.
解答 解:A2+2B-=2A-+B2,反应中A元素化合价0价变化为-1价,化合价降低做氧化剂,被还原得到还原产物A-,B元素化合价-1价变化为0价,化合价升高,做还原剂,被氧化生成氧化产物B2,得到氧化性A2>B2;同样的道理,反应B2+2C-=2B-+C2中B元素化合价0价变化为-1价,化合价降低做氧化剂,被还原得到还原产物B-,C元素化合价-1价变化为0价,化合价升高,做还原剂,被氧化生成氧化产物C2,得到氧化性B2>C2即氧化性:A2>B2>C2;
A.氧化性:A2>B2>C2,所以单质的活动性:A2>B2>C2,故A错误;
B.氧化性越强,其阴离子的还原性越弱,则还原性A-<B-<C-,故B错误;
C.由分析可知:氧化性:A2>B2>C2,故C正确;
D.氧化性:A2>C2,反应A2+2C-=2A-+C2可以证明这个氧化性顺序,所以该反应能发生,故D错误.
故选C.
点评 本题考查了氧化还原反应,侧重于氧化还原反应基本概念以及氧化性、还原性强弱比较的考查,注意把握氧化性和还原性的强弱比较方法和规律应用,题目难度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 石蕊试纸和pH试纸使用前都必须用蒸馏水润湿 | |
| B. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 | |
| C. | 电离和水解反应都是吸热过程 | |
| D. | 酸式盐的pH均小于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:10 | B. | 2:1 | C. | 105:1 | D. | 5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①②③ | C. | ①②④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
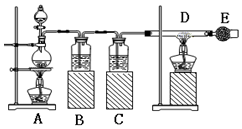 已知:氯化铁易潮解.如图是制取无水氯化铁的实验装置图,将分液漏斗中的浓盐酸加入到盛有二氧化锰的烧瓶中,请回答下列问题:
已知:氯化铁易潮解.如图是制取无水氯化铁的实验装置图,将分液漏斗中的浓盐酸加入到盛有二氧化锰的烧瓶中,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱性溶液中能大量存在:Na+、K+、Cl-、NH4+ | |
| B. | 加入金属铝后溶液中有大量气泡产生的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 含有大量Fe3+的溶液中:SCN-、I-、K+、Br- | |
| D. | 溶液通入足量氨气后各离子还能大量存在:K+ Na+ OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
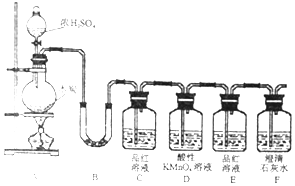
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、Cl-、OH- | B. | Fe2+、Mg2+、SO42-、Cl- | ||
| C. | K+、Na+、CO32-、OH- | D. | Na+、Ba2+、HCO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑧ | B. | ③⑥⑨⑩ | C. | ④⑤⑥⑧ | D. | ④⑤⑧⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com