
【题目】某同学用Na2CO3和NaHCO3溶液进行如图所示实验。下列说法中,正确的是( )

A.实验前两电解质在溶液中都有电离平衡存在
B.实验前两溶液中离子种类完全相同
C.加入CaCl2溶液后生成的沉淀一样多
D.实验前两溶液的pH右>左
【答案】B
【解析】
A. Na2CO3在溶液中完全电离,电离产生的CO32-发生水解,NaHCO3在溶液中完全电离,电离生成的HCO3-在溶液中既能电离又能水解,所以实验前Na2CO3在溶液中不存在电离平衡,但NaHCO3在溶液中存在电离平衡,A错误;
B. 实验前两溶液中都存在Na+、CO32-、HCO3-、OH-、H+,离子种类完全相同,B正确。
C. 加入CaCl2溶液后生成的沉淀不一样多,因为Na2CO3+CaCl2=CaCO3↓+2NaCl,2NaHCO3+CaCl2=CaCO3↓+NaCl+H2O+CO2↑,C错误;
D. 实验前相同浓度的Na2CO3和NaHCO3溶液,前者水解程度大,所以两溶液的pH左>右,D错误。
故选B。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素。如图是实验室从海藻里提取碘的流程的一部分。下列判断正确的是
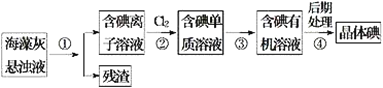
A. 步骤④的操作是过滤
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤①、③的操作分别是过滤、萃取
D. 步骤③中加入的有机溶剂可能是酒精或四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,1.7g氨气所占的体积为_____L,它与标准状况下_____L硫化氢含有相同数目的氢原子.
(2)某气态氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_____.
(3)已知CO、CO2的混合气体质量共16.0g,标准状况下体积为8.96L,则可推知该混合气体中含CO_____g,该混合气体一定条件下完全转化为二氧化碳后通入2.5mol/L氢氧化钠溶液,最多消耗该氢氧化钠溶液体积__________ml.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。

(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
试剂a | 试剂b | 试剂c | 实验目的 |
| |
① | 盐溶液X | NaOH | 酚酞 | 证明X中含有NH4+ | |
② | 浓盐酸 | CaCO3 | Na2SiO3溶液 | 证明酸性: HCl>H2CO3>H2SiO3 | |
③ | 浓盐酸 | MnO2 | 淀粉KI溶液 | 证明氧化性:MnO2>Cl2>I2 | |
④ | 浓硫酸 | C | 澄清石灰水 | 证明产物中含有CO2 |
A.①②③B.①③C.②③D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
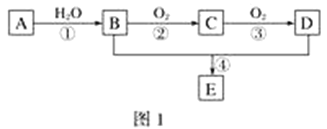
(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。
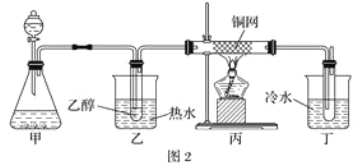
①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁是一种新型高效的无机高分子絮凝剂。用硫酸亚铁晶体及硫酸为原料催化氧化法生成硫酸铁,再水解、聚合成产品。实验室模拟生产过程如下:
![]()
已知Fe3+能水解成氢氧化铁:Fe3++3H2O===Fe(OH)3+3H+,为了防止Fe3+水解需加入硫酸。
(1)①用原料配制2.50 moL·L-1的硫酸亚铁溶液时用到的定量仪器有_________________。
②写出氧化过程中的离子方程式:________。
(2)综合考虑实际投料硫酸亚铁与硫酸的物质的量之比为1/1.25左右最佳,加入的硫酸比理论值稍多,但不能过多的原因是__________________________________。
(3)硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3·ySO3·zH2O),现采用重量法测定x、y、z的值。
①测定时所需的试剂是______(填选项序号)。
A.NaOH B. Ba(OH)2
C.BaCl2D.FeSO4
②需要测定________和__________的质量(填写化合物的化学式)。
(4)选出测定过程中所需的基本操作(按操作先后顺序列出) ______________(填序号)。
①过滤、洗涤 ②蒸发、结晶 ③萃取、分液 ④冷却、称量 ⑤烘干或灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是
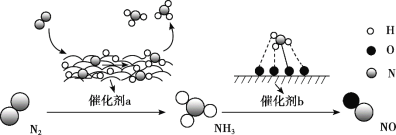
A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】慢心律是一种治疗心律失常的药物。它的合成路线如图所示。
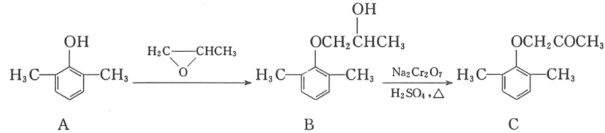
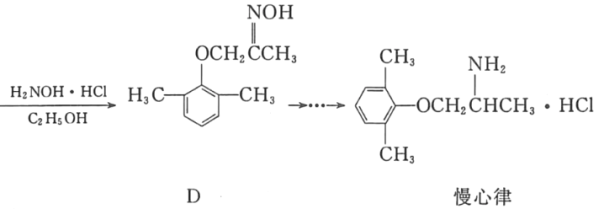
(1)C中的含氧官能团名称为_____和_____;
(2)由B→C的反应类型是_____。
(3)由A制备B的过程中有少量副产物E,它与B互为同分异构体。写出E的结构简式:_____。
(4)写出同时满足下列条件的化合物D的一种同分异构体的结构简式:_____。
①属于a﹣氨基酸;②是苯的衍生物,且苯环上的一氯代物只有两种;③分子中有2个手性碳原子
(5)已知乙烯在催化剂作用下与氧气反应可以生成环氧乙烷(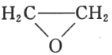 )。写出以邻甲基苯酚(
)。写出以邻甲基苯酚( )和乙醇为原料制备
)和乙醇为原料制备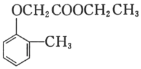 的合成路线流程图(无机试剂任用)。合成路线流程图示例见本题题干_____。
的合成路线流程图(无机试剂任用)。合成路线流程图示例见本题题干_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com