
【题目】利用碳酸钠晶体(Na2CO310H2O)来配制1.0molL﹣1 Na2CO3溶液500mL,假如其他操作均准确无误,下列情况会引起所配溶液浓度偏高的是( )
A.称取碳酸钠晶体53.0g
B.移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗
C.定容时,俯视观察刻度线
D.定容后,将容量瓶反复倒转、摇匀、静置时发现液面低于刻度线,于是又加入少量水至刻度线
【答案】C
【解析】解:A.配制1.0molL﹣1 Na2CO3溶液500mL,应称量碳酸钠晶体质量m=1.0mol/L×0.5L×286g/mol=143.0g,称取碳酸钠晶体53.0g,导致称取的溶质的质量偏小,溶质的物质的量偏小,溶液浓度偏低,故A错误;
B.移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗,导致部分溶质损失,溶质的物质的量偏小,溶液浓度偏低,故B错误;
C.定容时,俯视观察刻度线,导致溶液体积偏小,溶液的物质的量浓度偏高,故C正确;
D.定容后,将容量瓶反复倒转、摇匀、静置时发现液面低于刻度线,于是又加入少量水至刻度线,导致溶液体积偏大,溶液浓度偏低,故D错误;
故选:C.
分析操作对溶质的物质的量和溶液体积的影响,依据C= ![]() 进行误差分析,凡是使n偏大或者是V偏小的操作,都会使溶液浓度偏高,反正使溶液浓度偏低,据此解答.
进行误差分析,凡是使n偏大或者是V偏小的操作,都会使溶液浓度偏高,反正使溶液浓度偏低,据此解答.


科目:高中化学 来源: 题型:
【题目】某实验小组为探究ClO﹣、I2、SO ![]() 在酸性条件下的氧化性强弱,已知I2遇淀粉变蓝,设计实验如下: 实验①:在淀粉KI溶液中加入少量NaClO溶液,并加入少量的稀H2SO4 , 溶液立即变蓝;
在酸性条件下的氧化性强弱,已知I2遇淀粉变蓝,设计实验如下: 实验①:在淀粉KI溶液中加入少量NaClO溶液,并加入少量的稀H2SO4 , 溶液立即变蓝;
实验②:向实验①的溶液中加入4L 0.5mol/L的Na2SO3溶液,发生反应如下
SO ![]() +I2+H2O→SO
+I2+H2O→SO ![]() +I﹣+H+(未配平),恰好完全反应.
+I﹣+H+(未配平),恰好完全反应.
(1)以上实验说明,在酸性条件下ClO﹣、I2、SO42﹣的氧化性由弱到强的顺序是 .
(2)实验②中化学反应转移电子的物质的量是 .
(3)写出实验①中发生反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本题共10分)研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g) ![]() H= 242.0 kJ/mol
H= 242.0 kJ/mol
C(s)+1/2O2(g)=CO(g) ![]() H= 110.0 kJ/mol
H= 110.0 kJ/mol
①写出焦炭与水蒸气反应制H2和CO的热化学方程式 。
②已知在101kPa时,CO、 H2和CH4的燃烧热分别为283kJ/mol、286 kJ/mol和892kJ/mol。则反应CH4(g)+ H2O(g) ![]() CO(g)+3H2(g)△H= kJ/mol。
CO(g)+3H2(g)△H= kJ/mol。
(2)已知一定温度和压强下,由H2和CO反应合成优质燃料甲醇:
CO(g)+2H2(g)![]() CH3OH(g)△H=-91kJ/mo1
CH3OH(g)△H=-91kJ/mo1
①在相同条件下要想得到182kJ热量,加入各物质的物质的量可能是 。
A.2mo1 CO和4mol H2 B.2mo1 CO、4mol H2和1mol CH3OH(g)
C.4mo1 CO和4mol H2 D.4mo1 CO和6mol H2
②将1mol CO和2mol H2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%。若在相同条件下,起始时在该容器中充入1mol CH3OH(g),反应达到平衡时的热量变化是 (填“吸收”或“放出”) kJ热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,则下列说法不正确的是
A. 23g 钠在空气中充分燃烧,转移的电子数为NA
B. 50ml 12mol/L的盐酸与足量的MnO2共热,充分反应后,转移电子数为0.3NA
C. 0.6mol过氧化钠晶体中所含阴离子的数目为0.6NA
D. 常温常压下,8.8gN2O 和CO2混合气体所含的原子总数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学实验探究氨气的还原性并进行系列实验.
(1)将光亮的紫红色铜丝绕几圈后,在酒精灯火焰上加热,等铜丝变黑后,趁热将铜丝插入疏松的氯化铵晶体里,即刻发现有白色烟雾生成,拿出铜丝后,铜丝又转变为光亮的紫红色.在焊接铜器时用氯化铵除去铜器表面的氧化铜即利用了该原理,请完成该反应: CuO+NH4Cl=Cu+CuCl2+N2↑+
(2)利用下列装置,进行与金属氧化物MxOy反应生成M、H2、H2O,通过测量生成水的质量来测定M的相对原子质量.a中试剂是浓氨水. 
①仪器a的名称为 , 仪器b中装入的试剂可以是 .
②按气流方向正确的装置连接(填序号,装置可重复使用): .
③实验结束时,应首先(填序号).
I.熄灭A装置的酒精灯
II.停止从a中滴加液体
④若实验中准确称取金属氧化物的质量为mg,完全反应后,测得生成水的质量为ng,则M的相对原子质量为(用x、y、m、n的式子表示).
(3)若金属氧化物MxOy为Fe2O3 , 将反应后固体溶于稀硫酸,然后滴加KSCN溶于没发现明显变化.推测该固体成分可能是(将化学式填入下表,你认为有几种可能填几种).
序号 | 固体成分(填化学式) |
1 | |
2 | |
3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铁和铁合金的有关说法错误的是
A. 工业上用一氧化碳将铁矿石中的铁还原出来
B. 不锈钢抗腐蚀性能好,长期使用绝对不会生锈
C. 制造铁轨、船舶、桥梁的碳素钢是铁和碳的合金
D. 使用铁锅烧饭菜能为人体提供微量的铁元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米铜有很多奇特的性质,比如超塑延展性,在室温下可拉长50多倍而不出现裂纹,铜纳米晶体的这种机械特性为制造常温下的弹性物质开辟了光明前景。此外,纳米铜还用作热氨发生器、凝胶推进剂、燃烧活性剂、催化剂、水清洁吸附剂、烧结活性剂等。纳米铜比普通铜更容易与氧气发生反应,常温下在空气中可以自燃。以下是纳米铜的一种制备工艺,用于制备50~100nm的铜粉。

已知:油酸(C17H33COOH)难溶于水,可溶于乙醇。
步骤①中发生的反应为:2C17H33COOH +Cu2+![]() Cu(C17H33COO)2 +2H+
Cu(C17H33COO)2 +2H+
步骤②中发生的反应为:2Cu(C17H33COO)2 + C6H12O6+5OH- =Cu2O+C5H11COO-+4C17H33COO-
回答下列问题:
(1)将纳米铜粉加人燕馏水中,搅拌均匀后,得到的分散系类型是_________
(2)步骤①中调节pH5.5~6.0时,萃取率最高,pH不能过大也不能过小,若过小则______,若过大则__。
(3)NaH2PO2中P的化合价是_______,在步骤③中被氧化得到的产物是NaH2PO3,该反应的化学方程式是_____。已知NaH2PO2为正盐且溶液呈碱性.NaH2PO2溶液呈碱性原因用离子方程式可表示为_。
(4)用乙醇清洗产物的目的是__________。
(5)真空干燥产品的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
![]() +H2O+H2SO4
+H2O+H2SO4![]()
![]() +NH4HSO4
+NH4HSO4
![]() + Cu(OH)2
+ Cu(OH)2![]()
![]() +H2O
+H2O
制备苯乙酸的装置示意图如图(加热和夹持装置等略)。
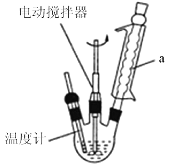
己知: 苯乙酸的熔点为76.5℃,可升华,易溶于热水,微溶于冷水,溶于乙醇。
请回答下列问题:
(1)将装置中的溶液加热至100℃,缓缓滴加40g 苯乙腈到硫酸溶液中,然后升温至130℃继续反应,在装置示意图中,仪器a的名称是________,其作用是_____________;
(2)反应结束后加适量冷水,可分离出苯乙酸粗品,其加入冷水的目的是____________;下列仪器中可用于分离苯乙酸粗品的是_______(填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)如果要将苯乙酸粗品进一步提纯,你选择的实验方法是___________(填二种方法)。
(4)用CuCl2·2H2O和NaOH 溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是____________;
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是____________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com