
在K2Cr2O7溶液中存在如下平衡:Cr2O72﹣+H2O⇌2CrO42﹣+2H+.向橙色的K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是( )
|
| A. | 加入X溶液,上述平衡正向移动 |
|
| B. | Cr2O72﹣的物质的量浓度增大 |
|
| C. | X溶液可能是NaOH溶液 |
|
| D. | 再加入H2SO4,可使黄色溶液变为橙色 |
| 化学平衡的影响因素. | |
| 专题: | 化学平衡专题. |
| 分析: | 在K2Cr2O7溶液中存在如下平衡:Cr2O72﹣+H2O⇌2CrO42﹣+2H+,向橙色的K2Cr2O7溶液中加入X溶液,可使溶液变黄,说明平衡正向进行,依据平衡移动原理分析判断. |
| 解答: | 解:A、向橙色的K2Cr2O7溶液中加入X溶液,可使溶液变黄,说明平衡正向进行,故A正确; B、若Cr2O72﹣的物质的量浓度增大,溶液成橙色,故B错误; C、X溶液可能是NaOH溶液,加入和氢离子反应,化学平衡正向进行,溶液成黄色,故C正确; D、加入H2SO4,氢离子浓度增大,平衡逆向进行,可使黄色溶液变为橙色,故D正确; 故选B. |
| 点评: | 本题考查了化学平衡影响因素分析,化学平衡移动原理的应用,掌握反应离子特征和平衡移动方向是关键,题目较简单. |


科目:高中化学 来源: 题型:
反应3NO2+H2O=2HNO3+NO中,当有4mol电子发生转移时,被氧化的物质与被还原的物质的物质的量之比是()
A. 1:1 B. 1:2 C. 2:1 D. 3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、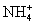 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、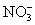 、
、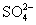 、
、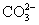 。已知:
。已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
回答下列问题:
(1)五种盐中,一定没有的阳离子是 ;
所含的阴离子相同的两种盐的化学式是 。
(2)D的化学式为 ,D溶液显碱性的原因是(用离子方程式表示) 。
(3)A和C的溶液反应的离子方程式是 。
E和氨水反应的离子方程式是 。
(4)若要检验B中所含的阳离子,正确的实验方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)如图所示的是干冰的晶胞结构。观察此图,发现干冰的晶胞呈________体。在干冰晶体中CO2分子之间通过________结合为晶体。
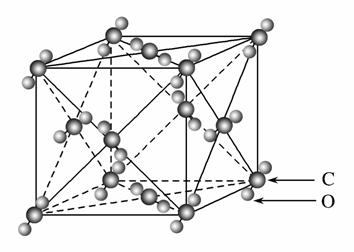
(2)试判断:①CO2 ②CS2 ③SiO2晶体的沸点由高到低排列的顺序是________>________>________(填写相应物质的编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式正确的是( )
|
| A. | NH3•H2O═NH4﹣+OH﹣ | B. | NaHCO3═Na++H++CO32﹣ |
|
| C. | CH3COONa═CH3COO﹣+Na+ | D. | H2S⇌2H++S2﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中一定能判断某化学平衡发生移动的是( )
|
| A. | 混合物中各组分的浓度发生改变 |
|
| B. | 正、逆反应速率发生改变 |
|
| C. | 反应物的转化率发生改变 |
|
| D. | 混合体系的压强发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应mX(g)+nY(g)⇌qZ(g)△H>0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
|
| A. | 升高温度: |
|
| B. | 降低温度,混合气体的平均相对分子质量减小 |
|
| C. | 通入稀有气体,压强增大,平衡向正反应方向移动 |
|
| D. | X的正反应速率是Y的逆反应速率的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
由乙烯和其他无机原料合成环状化合物,其合成过程如图(水及其他无机产物均已省略)。
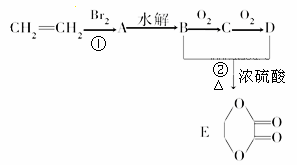
请分析后回答下列问题:
(1)写出下列反应的反应类型:① ,② 。
(2)D物质中的官能团名称为 。
(3)物质X与A互为同分异构体,则X的结构简式为 。
(4)A→B的反应条件为 。
(5)写出下列转化的化学方程式:C→D 。B+D→E 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com