
| A. | H2(g)+Br2(g)?2HBr(g) | B. | N2(g)+3H2(g)?2NH3(g) | C. | 2SO2(g)+O2(g)?2SO3(g) | D. | C(s)+CO2(g)?2CO(g) |
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 除去乙烷中少量的乙烯:气体通过盛酸性高锰酸钾溶液的洗气瓶 | |
| B. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤、分液、干燥、蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙醇中少量的乙酸:加足量生石灰、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )| A. | 原氨水浓度x=0.01mol•L-1 | |
| B. | m、p两点溶液中由水电离出来的c(OH-):m>p | |
| C. | n点溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 若在m点溶液中加少量水,[c(NH3•H2O)•c(H+)]/c(NH4+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4g铜在足量的氯气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,2.24L乙醇中含有的氧原子数为0.1NA | |
| C. | 2.0gH218O与D216O的混合物中所含质子数为NA | |
| D. | 0.1L0.5 mol•L-1CH3COOH溶液中含有的H+数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
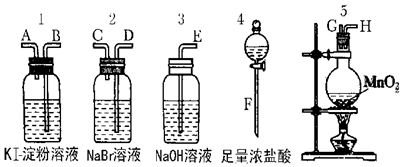
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
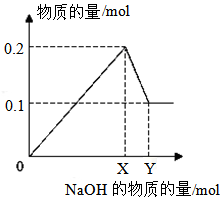 I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol.
I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com