
分析 利用三段式分析,计算得平衡时各物质的浓度,
A(g)+2B(g)?2C(g)+D(g),
开始(mol/L) 2 1 0 0
转化(mol/L)0.4 0.8 0.8 0.4
平衡(mol/L)1.6 0.2 0.8 0.4
根据K=$\frac{{c}^{2}(C)c(D)}{c(A){c}^{2}(B)}$计算平衡常数,根据转化率=$\frac{已转化的浓度}{起始的浓度}$×100%计算.
解答 解:利用三段式分析,计算得平衡时各物质的浓度,
A(g)+2B(g)?2C(g)+D(g),
开始(mol/L) 2 1 0 0
转化(mol/L)0.4 0.8 0.8 0.4
平衡(mol/L)1.6 0.2 0.8 0.4
所以K=$\frac{{c}^{2}(C)c(D)}{c(A){c}^{2}(B)}$=$\frac{0.4×0.{8}^{2}}{0.{2}^{2}×1.6}$=4,A的转化率=$\frac{已转化的浓度}{起始的浓度}$×100%=$\frac{0.4}{2}$×100%=20%,
答:此条件下该反应的化学平衡常数为4,A的转化率为20%.
点评 本题考查化学平衡的计算,熟悉化学平衡的三段法计算及平衡常数、转化率的计算即可解答,注意各物质的浓度的计算,题目难度中等.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:解答题
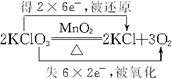 .
.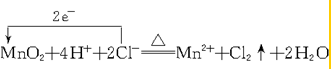 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青蒿素的摩尔质量为282g | |
| B. | 青蒿素的化学合成方法没有任何研究意义 | |
| C. | 青蒿素转化为双氢青蒿素是物理变化 | |
| D. | 用乙醚提取黄花蒿叶中的青蒿素比用水效果好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个Fe(OH)3胶体粒子的质量为107g | |
| B. | 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA | |
| C. | 1 molCl2与足量Fe反应转移电子数一定为2NA | |
| D. | 2.3gNa与氧气完全反应,反应中转移的电子数0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
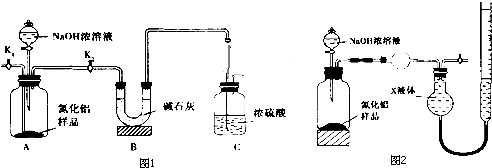

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 分类标准 | 单质 | 碱性氧化物 | 酸性氧化物 | 含氧酸 | 盐 | 电解质 |
| 属于该类的物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com