

| A. | 生成等量的CuSO4时,②消耗的酸最少,且能体现绿色化学思想 | |
| B. | 反应⑥中Y可以是葡萄糖或乙醛溶液 | |
| C. | 反应④所得混合气体X中一定有O2 | |
| D. | 反应①中H2SO4与HNO3物质的量最佳比为3:1 |
分析 A.由Cu原子守恒可知,相同物质的量的Cu最终得到相同的硫酸铜,②中硫酸作酸;
B.反应⑥为氢氧化铜氧化-CHO的反应;
C.反应④中Cu元素的化合价降低,则O元素的化合价必定升高;
D.发生3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,以此来解答.
解答 解:A.由Cu原子守恒可知,相同物质的量的Cu最终得到相同的硫酸铜,②中硫酸作酸,①、③中铜和浓硫酸反应会生成二氧化硫气体污染空气,消耗酸多,故A正确;
B.葡萄糖与氢氧化铜反应的方程式为:C6H12O6+2Cu(OH)2$\stackrel{△}{→}$C6H12O7+Cu2O+2H2O,所以Y可为葡萄糖或乙醛溶液,故B正确;
C. 硫酸铜分解生成Cu2O,Cu元素的化合价降低,S元素为最高价不能升高,所以O元素的化合价升高,即有氧气生成,根据2CuSO4═Cu2O+SO2↑+SO3↑+O2↑知,所得混合气体X中一定有O2,故C正确;
D.Cu与混酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,从方程式知,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,所以硝酸为2mol时,硫酸为3mol,用混酸中H2SO4与HNO3物质的量之比最好为3:2,故D错误;
故选D.
点评 本题考查制备实验的评价,为高频考点,把握制备实验原理、环境保护及发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
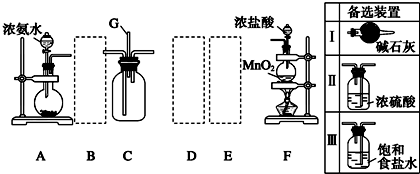
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
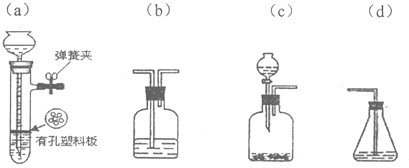
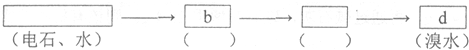
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述各反应均既属于氧化还原反应,有属于离子反应 | |
| B. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 | |
| C. | 盐酸的浓度越大,Cl-的还原性越强 | |
| D. | 每生成1molCl2,上述各反应转移的电子数均为2NA(NA为阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
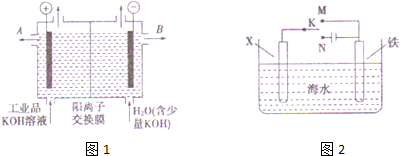
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com