
 在生产生活中,酸碱中和及溶液酸碱性研究具有十分重要的意义.
在生产生活中,酸碱中和及溶液酸碱性研究具有十分重要的意义.| 组别 | c(一元酸) | c(NaOH) | 混合溶液的pH |
| 甲 | c(HY)=0.1mol/L | 0.1mol/L | pH=7 |
| 乙 | c(HZ)=0.1mol/L | 0.1mol/L | pH=9 |


科目:高中化学 来源: 题型:
| A、加入水时,平衡向逆反应方向移动 |
| B、加入少量NaOH固体,平衡向逆反应方向移动 |
| C、加入少量 0.1mol?L-1盐酸,溶液中c(H+)减小 |
| D、加入少量NH4Cl固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,5.6 g乙烯和环丙烷的混合气体中含有的碳原子数为0.4 NA |
| B、1 mol Cl2通入足量水中反应转移的电子数为NA |
| C、0.1 mol/L Na2CO3溶液中CO32-、HCO3-和H2CO3总数为0.1 NA |
| D、标准状况下,2.24 L三氯甲烷中含有C-Cl数目为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| △ |
| A、5种 | B、6种 | C、7种 | D、8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
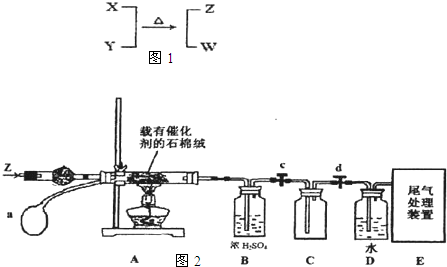
| T/K | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、当d极消耗2g H2 时,a极周围会产生22.4L H2 |
| B、电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| C、c极上发生的电极反应是:O2+2H2O+4e-=4OH- |
| D、c极上进行还原反应,B中的H+可以通过隔膜进入A |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com